题目内容
5.向20mL AlCl3溶液中加入30mL 1.0mol•L-1 的氨水恰好沉淀完全,则原AlCl3的物质的量浓度为0.5mol/L.分析 发生反应:AlCl3+3NH3.H2O=Al(OH)3↓+3NH4Cl,根据n=cV计算NH3的物质的量,根据方程式计算n(AlCl3),再根据c=$\frac{n}{V}$计算.
解答 解:由AlCl3+3NH3.H2O=Al(OH)3↓+3NH4Cl,可知n(AlCl3)=$\frac{1}{3}$n(NH3.H2O)=$\frac{1}{3}$×0.03L×1mol/L=0.01mol,则c(AlCl3)=$\frac{0.01mol}{0.02L}$=0.5mol/L,
故答案为:0.5mol/L.
点评 本题考查化学方程式计算,比较基础,明确发生的反应即可解答,有利于基础知识的巩固.

练习册系列答案
相关题目
15.为了证明某晶体中含有NH4+、K+、SO42-和H2O,下列实验叙述中不正确的是( )
| A. | 取少量晶体放入试管中,加热,若试管口上蘸有少量无水硫酸铜粉末的脱脂棉变蓝,则可证明晶体中含有结晶水 | |
| B. | 取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH4+ | |
| C. | 取少量晶体溶于水,加适量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量晶体溶于水,用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,不能证明晶体中无K+ |
13.下列反应中属于加成反应的是( )
| A. | 乙炔的燃烧 | B. | 苯的硝化反应 | ||
| C. | 乙烷跟氯气反应生成一氯乙烷 | D. | 乙烯与氯化氢作用生成一氯乙烷 |
20.下列离子方程式书写正确的是( )
| A. | 浓氢氧化钠溶液中加入铝Al+2OH-═AlO2-+H2↑ | |
| B. | 氯化铝溶于水发生水解Al3++3H2O═Al(OH)3+3H+ | |
| C. | 明矾溶液中加入少量的氢氧化钡溶液Al3++3OH-═Al(OH)3↓ | |
| D. | 硫酸铝溶液中加入过量氢氧化钠溶液Al3++4OH-═AlO2-+2H2O |
10.用NA表示阿伏加德罗常数,下列的叙述正确的是( )
| A. | 在2L0.15 mol/L K2SO4溶液中,含有K+和SO42-的总数为0.9NA | |
| B. | 在标准状况下46 g NO2含有NA个分子 | |
| C. | ag某气体含有分子数为b,则c g该气体在标准状况下的体积是$\frac{22.4bc}{a{N}_{A}}$L | |
| D. | 当稀硝酸跟5.6 g Fe反应完全时,电子转移一定是0.3NA |
17.将硫化氢通入不同浓度的硝酸溶液中,发生下列反应:
①3H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$3S↓+2NO↑+4H2O
②H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$S↓+2NO2↑+2H2O
③4H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$4S↓+NH4NO3+3H2O
④5H2S+2HNO3═5S↓+N2↑+6H2O
结合所学有关硝酸的知识,判断硝酸浓度由大到小的顺序正确的是( )
①3H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$3S↓+2NO↑+4H2O
②H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$S↓+2NO2↑+2H2O
③4H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$4S↓+NH4NO3+3H2O
④5H2S+2HNO3═5S↓+N2↑+6H2O
结合所学有关硝酸的知识,判断硝酸浓度由大到小的顺序正确的是( )
| A. | ①>②>③>④ | B. | ②>①>④>③ | C. | ②>①>③>④ | D. | ④>③>①>② |
14.下列有关化学用语使用正确的是( )
| A. | CH4分子的比例模型: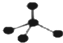 | B. | NH4Cl的电子式: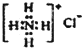 | ||
| C. | S2-结构示意图: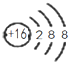 | D. | 聚丙烯的结构简式为: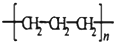 |