题目内容
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温常压下,1 mol Fe与足量稀HNO3反应,转移电子数目一定为为3NA | |
| B. | 0.1 mol/L NaHCO3溶液中含有Na+数目为0.1NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 常温下,1 mol Fe与足量浓硫酸反应,转移电子数目一定为为3NA |
分析 A、铁与足量的稀硝酸反应后变为+3价;
B、溶液体积不明确;
C、铜只能和浓硫酸反应,和稀硫酸不反应;
D、常温下,铁在浓硫酸中会钝化.
解答 解:A、铁与足量的稀硝酸反应后变为+3价,故1mol铁失去3mol电子即3NA个,故A正确;
B、溶液体积不明确,故溶液中的钠离子的个数无法计算,故B错误;
C、铜只能和浓硫酸反应,和稀硫酸不反应,故硫酸不能反应完全,则生成的二氧化硫分子个数小于0.46NA个,故C错误;
D、常温下,铁在浓硫酸中会钝化,反应程度很小,则转移的电子数小于3NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列关于铁的描述不正确的是( )
| A. | 在FeSO4溶液中滴入KSCN溶液,溶液显红色 | |
| B. | 铁位于元素周期表中第4周期第Ⅷ族 | |
| C. | 在化合物中,铁通常呈现为+2,+3价 | |
| D. | 通常情况下,铁丝在氯气里燃烧时生成FeCl3 |
13.下列反应中属于加成反应的是( )
| A. | 乙炔的燃烧 | B. | 苯的硝化反应 | ||
| C. | 乙烷跟氯气反应生成一氯乙烷 | D. | 乙烯与氯化氢作用生成一氯乙烷 |
10.用NA表示阿伏加德罗常数,下列的叙述正确的是( )
| A. | 在2L0.15 mol/L K2SO4溶液中,含有K+和SO42-的总数为0.9NA | |
| B. | 在标准状况下46 g NO2含有NA个分子 | |
| C. | ag某气体含有分子数为b,则c g该气体在标准状况下的体积是$\frac{22.4bc}{a{N}_{A}}$L | |
| D. | 当稀硝酸跟5.6 g Fe反应完全时,电子转移一定是0.3NA |
17.将硫化氢通入不同浓度的硝酸溶液中,发生下列反应:
①3H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$3S↓+2NO↑+4H2O
②H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$S↓+2NO2↑+2H2O
③4H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$4S↓+NH4NO3+3H2O
④5H2S+2HNO3═5S↓+N2↑+6H2O
结合所学有关硝酸的知识,判断硝酸浓度由大到小的顺序正确的是( )
①3H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$3S↓+2NO↑+4H2O
②H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$S↓+2NO2↑+2H2O
③4H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$4S↓+NH4NO3+3H2O
④5H2S+2HNO3═5S↓+N2↑+6H2O
结合所学有关硝酸的知识,判断硝酸浓度由大到小的顺序正确的是( )
| A. | ①>②>③>④ | B. | ②>①>④>③ | C. | ②>①>③>④ | D. | ④>③>①>② |
7.室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙两烧杯中溶液的描述不正确的是( )
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)=═c(OH-)乙 | |
| C. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,消耗NaOH溶液的体积不相同 |
14.下列有关化学用语使用正确的是( )
| A. | CH4分子的比例模型: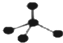 | B. | NH4Cl的电子式: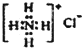 | ||
| C. | S2-结构示意图: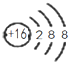 | D. | 聚丙烯的结构简式为: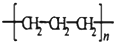 |
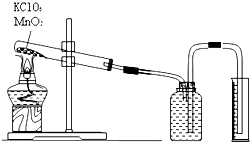 某小组设计利用氯酸钾制氧气来测定气体摩尔体积的探究实验.装置
某小组设计利用氯酸钾制氧气来测定气体摩尔体积的探究实验.装置