题目内容
4.为了配制c(Na+):c(HCO3-)=1:1的溶液,可向NaHCO3溶液中( )| A. | 通入HCl气体 | B. | 加入适量氢氧化钠固体 | ||
| C. | 加入适量KHCO3 | D. | 加入适量Na2CO3晶体 |
分析 碳酸氢钠溶液中碳酸氢根离子水解,导致溶液中碳酸氢根离子的浓度小于钠离子浓度,要使得碳酸氢根离子和钠离子浓度相等,需要加入的物质可以抑制碳酸氢根离子的水解即可,但是不能增加钠离子的浓度.
解答 解:A、通入HCl,会消耗碳酸氢根离子,所以使得碳酸氢根离子浓度减小,更加小于钠离子浓度,故A错误;
B、加入适量氢氧化钠固体,会消耗碳酸氢根离子,生成碳酸钠溶液,碳酸氢根离子浓度更小,钠离子浓度更大,故B错误;
C、加入碳酸氢钾可以增加碳酸氢根离子浓度,钠离子浓度不变,符合题意,故C正确;
D、加入碳酸钠晶体,会使得钠离子浓度增加,所以钠离子浓度更加大于碳酸氢根离子浓度,故D错误.
故选C.
点评 本题考查学生盐的水解平衡的影响因素以及水解平衡的移动知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
相关题目
14.下列有关化学用语使用正确的是( )
| A. | CH4分子的比例模型: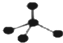 | B. | NH4Cl的电子式: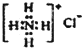 | ||
| C. | S2-结构示意图: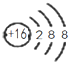 | D. | 聚丙烯的结构简式为: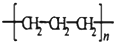 |
19.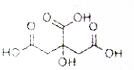 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价整合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价整合剂,也是化学中间体.下列关于物质X的说法正确的是( )
 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价整合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价整合剂,也是化学中间体.下列关于物质X的说法正确的是( )| A. | X分子式C6H7O7 | |
| B. | 1mol物质X可以和3mol氢气发生加成 | |
| C. | X可以发生氧化反应、取代反应和消去反应 | |
| D. | 1molX分别与足量的NaHCO3、Na反应得到的气体体积比为3:2 |
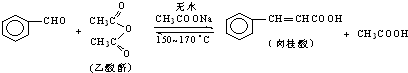
5. 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
药品物理常数
填空:
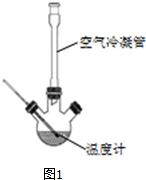
Ⅰ、合成:反应装置如图1所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ、粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:

(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是75%(保留两位有效数字)
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
药品物理常数
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |
Ⅰ、合成:反应装置如图1所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ、粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:

(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是75%(保留两位有效数字)
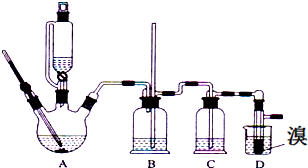
2.实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
有关数据列表如下:
回答下列问题:
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的两步反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br-Br→CH2Br-CH2Br
(2)装置B中玻璃管的作用控制气体流速,防止危险
(3)装置C中加入氢氧化钠溶液,其目的是吸收反应中生成的SO2、CO2气体 (填分子式)
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量未反应的Br2,最好用NaOH溶液试剂除去;
(7)若产物中有少量副产物乙醚.可用蒸馏方法除去.

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的两步反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br-Br→CH2Br-CH2Br
(2)装置B中玻璃管的作用控制气体流速,防止危险
(3)装置C中加入氢氧化钠溶液,其目的是吸收反应中生成的SO2、CO2气体 (填分子式)
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量未反应的Br2,最好用NaOH溶液试剂除去;
(7)若产物中有少量副产物乙醚.可用蒸馏方法除去.
3.下列有关实验的操作正确的是( )
| A. | 容量瓶可以用来溶解或稀释溶液 | |
| B. | 与硫酸铜溶液反应时可以取用大块的钠 | |
| C. | 可以用排饱和食盐水的方法收集氯气 | |
| D. | 制备氢氧化铁胶体时,需要不断加热和搅拌 |
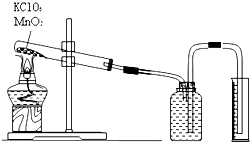 某小组设计利用氯酸钾制氧气来测定气体摩尔体积的探究实验.装置
某小组设计利用氯酸钾制氧气来测定气体摩尔体积的探究实验.装置