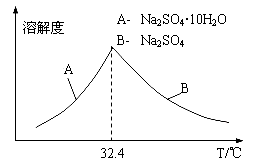
题目内容
【题目】(1)下列变化属于放热反应的是______________(填序号)。
①葡萄糖在人体内被氧化成CO2;②天然气的燃烧;③煅烧大理石;④稀盐酸与稀氨水混合;⑤生石灰与水反应生成熟石灰;⑥干冰的升华;⑦钠与水反应;⑧消石灰与氯化铵晶体的反应
(2)氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,请回答下列问题:
①若2 mol氢气完全燃烧生成水蒸气,则放出的热量______(填“大于”、“小于”或“等于”)572 kJ。
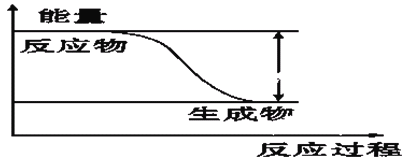
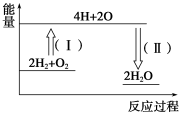
②反应2H2+O2==2H2O的能量变化如图所示。已知拆开1 mol H2、1 mol O2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ能量,则反应过程(Ⅱ)___(填“吸收”或“放出”)___kJ能量。
(3)已知反应2HI(g)==H2(g)+I2(g) ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为____kJ。
【答案】(1)①②④⑤⑦ (2)①小于 ②放出 1852(3)299
【解析】
试题分析:(1)①葡萄糖在人体内被氧化成CO2属于放热反应;②天然气的燃烧属于放热反应;③煅烧大理石属于吸热反应;④稀盐酸与稀氨水混合属于放热反应;⑤生石灰与水反应生成熟石灰属于放热反应;⑥干冰的升华是物理变化;⑦钠与水反应属于放热反应;⑧消石灰与氯化铵晶体的反应属于吸热反应,答案选①②④⑤⑦;
(2)①气态水的能量高于液态水,则若2 mol氢气完全燃烧生成水蒸气,则放出的热量小于572 kJ。
②反应2H2+O2==2H2O的能量变化如图所示。已知拆开1 mol H2、1 mol O2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ能量,则反应过程(Ⅱ)是原子结合成分子,属于形成化学键,根据放出热量,其放出的热量为463 kJ×4=1852kJ。
(3)反应热等于反应物键能之和和生成物键能之和的差值,则根据方程式可知2x-436kJ-151kJ=11kJ,解得x=299kJ,这说明1 mol HI(g)分子中化学键断裂时需吸收的能量为299kJ。