题目内容
【题目】一种处理污水的燃料电池模型如下图所示。该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙。下列叙述不正确的是
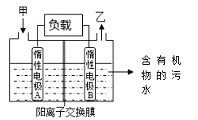
A. B电极为正极
B. 气体乙可能为CO2
C. O2在A电极得电子
D. 电池工作时,B电极附近的pH逐渐减小
【答案】A
【解析】试题分析:A.根据题意,该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙,则B电极为负极,A项错误;B.有机物是含碳元素的化合物,有机物失电子生成乙,则气体乙可能为CO2,B项正确;C.根据上述分析,电极A为正极,在燃料电池中,氧气在正极得电子,即O2在A电解得电子,C项正确;D.根据题意,细菌将污水中的有机物分解,在此过程中释放出电子、质子和乙,质子(H+)浓度增大,则B电极附近的pH逐渐减小,D项正确;答案选A。

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目