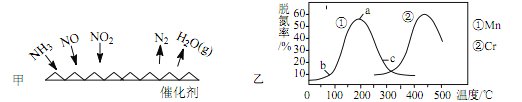��Ŀ����
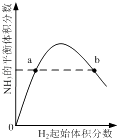
����Ŀ�����������¡����ݵ��ܱ������н��������������淴Ӧ��(��)2X(g)![]() Y(g)+Z(s)�� (��)A(s)+2B(g)
Y(g)+Z(s)�� (��)A(s)+2B(g)![]() C(g)+D(g)�����������������ٷ����仯ʱ�����Ա������Ҿ��ﵽƽ��״̬����
C(g)+D(g)�����������������ٷ����仯ʱ�����Ա������Ҿ��ﵽƽ��״̬����
�ٻ�������ܶ�
�ڷ�Ӧ������������İٷֺ���
�۷�Ӧ����������������������������֮�ȵ��ڻ�ѧ������֮��
�ܻ�������ѹǿ
�ݹ�������
�������������ʵ���
A���٢ڢۢܢݢ� B���٢ڢۢ� C���٢ڢ� D���ڢۢ�
���𰸡�B
��������
����������ټ��Ҿ��ɹ�����뷴Ӧ�����������ܶȲ��䣬����ƽ��״̬�ı�־����ѡ�� �ڷ�Ӧ������������İٷֺ�����˵������ֵ������䣬��ƽ��״̬����ѡ�� �۷�Ӧ����������������������������֮�ȵ���ϵ��֮�ȣ�˵�����淴Ӧ������ȣ���ѡ�����һ�������ѹǿʼ�ղ��䣬�ʲ�ѡ�� ��������������˵���������������ʲ��䣬����ƽ��״̬�ı�־����ѡ�� ���һ������������ʵ���ʼ�ղ��䣬�ʲ�ѡ�� ��ѡB��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����������Ҫ���ں��ա�ұ��������ҵ������������һ�����������������̼���̿�(��Ҫ����FeS2��FeCO3��SiO2��CuO������)�Ʊ������̵Ĺ�����������:
��֪:��.�����ƵĻ�ѧʽΪ(CH3)2CNS2Na,���ø����ƶ�MnSO4��Һ���ؽ������о���ȥ��Ч������:
��.���ֽ��������γ��������������pH���±���ʾ:
Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
pH(��ʼ����) | 7.5 | 5.2 | 1.7 | 7.2 |
pH(��ȫ����) | 9.7 | 7.8 | 3.2 | 10.4 |
�ش���������:
��1��FeS2��SԪ�صĻ��ϼ�Ϊ_____�ۡ�
��2������ʱ�����̿��е���Ҫ�ɷ�MnO2��FeS2����������ԭ��Ӧ,д���÷�Ӧ�Ļ�ѧ����ʽ:___
��3�������Һ�д��������Ŀ����__________(�����ӷ���ʽ��ʾ)��
��4������pH����ѷ�Χ��_______,�����ijɷ���______(�ѧʽ)��
��5��(CH3)2CNS2H����(CH3)2NH��CS2ͨ���ӳɷ�Ӧ�õ�,1mol(CH3)2NH��,���ۼ�����ĿΪ__NA��
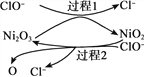
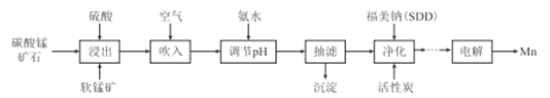
��6����ҵ�ϲ�����ͼ��ʾ�ķ�����ý���Mn��B��Ϊ____������û�������ӽ���Ĥ,Mn2+����D��������Ӧ����MnO2,��缫��ӦʽΪ____________��
����Ŀ�������������ڹ�ũҵ�����ж�����ҪӦ�á�
��1���£�N2H4���������ᷴӦ�����ɵ�����һ���⻯��ڱ�״���£����⻯��������ܶ�Ϊ1.92g/L�������е�Ԫ�ص���������Ϊ0.977����÷�Ӧ�Ļ�ѧ����ʽΪ____.
��2������������һ�������£����Է������·�Ӧ��SO2(g)+NO2(g)![]() SO3(g)+NO(g) ��H= -42kJ��mol-1����2L�ĺ����ܱ������г���SO2(g)��NO2(g)����ʵ���������£�
SO3(g)+NO(g) ��H= -42kJ��mol-1����2L�ĺ����ܱ������г���SO2(g)��NO2(g)����ʵ���������£�
ʵ���� | �¶� | ��ʼ���ʵ���mol | ƽ��ʱ���ʵ���/mol | |
n(SO2) | n(NO2) | n(NO) | ||
�� | T1 | 4.0 | 1.0 | 0.9 |
�� | T2 | 1.0 | 4.0 | 0.8 |
�� | T2 | 0.4 | 0.6 | a |
����ʵ����У���2minʱ��÷ų���������8.4kJ��0��2minʱ���ڣ���SO2��ʾ��ƽ����Ӧ����v(SO2)=_______________�����¶��µ�ƽ�ⳣ��Ϊ_________�������������С�������λ��
���ɱ������ݿ���֪��T1_______T2������>����<������=����
��ʵ����У��ﵽƽ��ʱNO2��ת����Ϊ______________.
��3����ҵ�Ͽ����ð�ˮ��SO2ת��ΪNH4HSO3����������(NH4)2SO4�������²��NH4HSO3��ҺpHΪ6������Һ��![]() ________________________.����֪��H2SO3��Kal =1.5��10-2Ka2 =1.0��10-7��
________________________.����֪��H2SO3��Kal =1.5��10-2Ka2 =1.0��10-7��
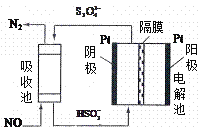
��4��ʹ�ü�ӵ绯ѧ�����Դ���ú�����е�NO��װ����ͼ����֪������Һ��pH��4��7֮�䣬д�������ĵ缫��Ӧʽ__________________��
 ��
��