题目内容
【题目】消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法: 某研究小组向某密闭容器中加入足量的活性炭和 NO,发生反应:C(s)+2NO(g) ![]() N2(g)+CO2(g) H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
N2(g)+CO2(g) H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:

①0~10 min 内, N2 的平均反应速率 υ(N2)=________ , T1℃时,该反应的平衡常数 K=_____。
②30 min 后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是____________ (填字母)
a. 加入一定量的活性炭 b. 改变反应体系的温度
c. 缩小容器的体积 d. 通入一定量的 NO
③若 30 min 后升高温度至 T2℃,重新达到平衡时,容器中 NO、 N2、 CO2 的浓度之比为 7∶3∶3,则该反应的H______0(填“>” 、 “ =” 、或“<” )
(2)NH3 催化还原法: 原理如图所示
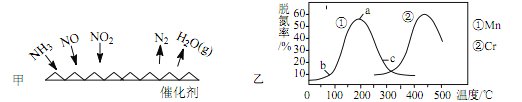
①若烟气中 c(NO2): c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移 1.5mol 电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为_____ 。
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_____ ;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是_____。
(3)已知常温下 Ka1(H2SO3)=1.810-2, Ka2(H2SO3)=6.010-9。 汽车尾气中的 SO2 用石灰水来吸收,生成的 CaSO3 浊液 pH=9.0,忽略 SO32-的第二步水解,则Ksp(CaSO3)=_____。
【答案】 0.03 mol·L-1·min-1 K=4 c d < 2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O(g) ΔH=-455.2 kJ/mol Mn 、200℃ b~a段,温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡(反应限度),随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高; 4.2×10-9
2N2(g)+3H2O(g) ΔH=-455.2 kJ/mol Mn 、200℃ b~a段,温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡(反应限度),随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高; 4.2×10-9
【解析】(1)①分析图表数据结合化学反应速率概念计算v,计算平衡浓度结合平衡常数概念是生成物浓度的幂次方乘积除以反应物的幂次方乘积得到;②反应前后是气体体积不变的反应,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大,说明改变的条件是缩小体积增大浓度,或加入一氧化氮达到新平衡后个物质浓度增大;③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为7:3:3,根据Qc与K的相对大小判断平衡移动方向,逆反应方向是吸热反应,正反应为放热反应;
(2)①得电子化合价降低的反应物是氧化剂;
②
(3)
(1)①分析图表数据,0~10min内,N2的平均反应速率v(N2)=0.03 mol/(L/min),
化学平衡三段式列式计算平衡浓度:
C(s)+2NO(g)= N2(g)+CO2(g);
起始量(mol/L) 1 0 0
变化量(mol/L) 0.8 0.4 0.4
平衡量(mol/L) 0.2 0.4 0.4
K=![]() =4
=4
②30min后,只改变某一条件,反应重新达到平衡,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大;a.加入一定量的活性炭是固体,对平衡无影响,故a不符合;
b.改变反应体系的温度, 达到平衡后一氧化氮、氮气、二氧化碳浓度不可能都增大,故b不符合;c.当缩小容器的体积,反应前后是气体体积不变的反应,平衡不动,但个物质浓度增大,符合要求,故c符合;d.通入一定量的NO,反应正向进行,达到平衡后一氧化氮、氮气、二氧化碳浓度增大,适故答案为:bc;
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为7:3:3,Qc=![]() <4,,这说明升高温度平衡向逆反应方向移动,因此逆反应是吸热反应,则正反应是放热反应,故Q<0,故答案为:<;
<4,,这说明升高温度平衡向逆反应方向移动,因此逆反应是吸热反应,则正反应是放热反应,故Q<0,故答案为:<;
(2)①由图甲可知NH3与NO、NO2反应产物为N2和水,故氧化剂为NO、NO2;因此反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-455.2 kJ/mol;
②根据图乙知Mn催化剂时,在200℃左右脱氮率最高,Cr作催化剂,500℃左右脱氮率最高,但二者的最高脱氮率差不多,使用Mn作催化剂需要的温度低,更经济,因此使用的最佳的催化剂和相应的温度分别为Mn、200℃左右;故答案为:Mn、200℃;使用 Mn 作催化剂时,脱氮率 b~a 段呈现上升状态,可能的原因是:b~a段,温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡(反应限度),随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高;
(3)由Ka2(H2SO3)=6.0×10-9可知SO32-+H2OHSO3-+OH-的水解Kh=![]() ==1.67×10-6,
==1.67×10-6,
常温下,测得某纯CaSO3与水形成的浊液pH为9,c(HSO3-)=c(OH-)=1×10-5,可知c(SO32-)=![]() =6×10-5,
=6×10-5,
又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5,
Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9。

 阅读快车系列答案
阅读快车系列答案