题目内容
【题目】金属锰主要用在航空、冶金及化工等行业。采用“两矿一步法”浸出高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)制备金属锰的工艺流程如下:
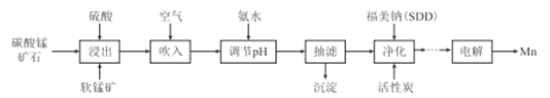
已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对MnSO4溶液中重金属进行净化去除效果良好:
Ⅱ.部分金属离子形成氢氧化物沉淀的pH如下表所示:
Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
pH(开始沉淀) | 7.5 | 5.2 | 1.7 | 7.2 |
pH(完全沉淀) | 9.7 | 7.8 | 3.2 | 10.4 |
回答下列问题:
(1)FeS2中S元素的化合价为_____价。
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,写出该反应的化学方程式:___
(3)向浸出液中吹入空气的目的是__________(用离子方程式表示)。
(4)调节pH的最佳范围是_______,沉淀的成分是______(填化学式)。
(5)(CH3)2CNS2H可由(CH3)2NH与CS2通过加成反应得到,1mol(CH3)2NH中,共价键的数目为__NA。
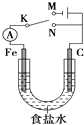
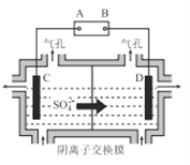
(6)工业上采用如图所示的方法获得金属Mn,B极为____极,若没有阴离子交换膜,Mn2+将在D极发生反应生成MnO2,则电极反应式为____________。
【答案】 -1 15MnO2+2FeS2+14H2SO4=15MnSO4+Fe2(SO4)3+14H2O 4Fe2++O2+4H+=4Fe3++2H2O 3.2≦pH<7.2 Fe(OH)3、SiO2、Cu(OH)2 9 正 Mn2++2H2O-2e-=MnO2+4H+
【解析】高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)用硫酸溶解,同时二氧化锰与FeS2发生氧化还原反应,溶液中存在Fe3+、Cu2+、Mn2+,吹入空气将亚铁离子完全氧化,在加入氨水,调节pH使Fe3+、Cu2+沉淀除去,加入福美钠 (CH3)2CNS2Na除去MnSO4溶液中的重金属离子,最后电解生成金属锰。
(1)FeS2中Fe为+2价,则S元素的化合价为-1价,故答案为:-1;
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,生成硫酸锰和硫酸铁,反应的化学方程式为15MnO2+2FeS2+14H2SO4=15MnSO4+Fe2(SO4)3+14H2O,故答案为:15MnO2+2FeS2+14H2SO4=15MnSO4+Fe2(SO4)3+14H2O;
(3)向浸出液中吹入空气是将亚铁离子完全氧化,4Fe2++O2+4H+=4Fe3++2H2O,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(4)根据Fe3+、Cu2+、Mn2+金属离子形成氢氧化物沉淀的pH值,3.2≦pH<7.2时,Fe3+、Cu2+沉淀,且不影响Mn2+,沉淀中主要含有Fe(OH)3、SiO2、Cu(OH)2,溶液中还含有少量Cu2+,故答案为:3.2≦pH<7.2;Fe(OH)3、SiO2、Cu(OH)2;
(5) (CH3)2NH可以看成氨气中的氢原子被甲基取代后的产物,1mol(CH3)2NH中,含有9mol共价键,故答案为:9;
(6)根据图示,该装置为电解池,硫酸根离子从C移向D,因此C池阴极,溶液中Mn2+离子放电生成金属锰,D为阳极,溶液中氢氧根离子放电生成氧气,则A为电源分解,B为正极,若没有阴离子交换膜,溶液中的Mn2+可能在阳极被氧化生成MnO2,电极反应式为Mn2++2H2O-2e-=MnO2+4H+,故答案为:正;Mn2++2H2O-2e-=MnO2+4H+。

 名校课堂系列答案
名校课堂系列答案