��Ŀ����
����Ŀ������ͼʾ���Ӧ��������������ǣ�������
A. ��ʾ1 LpH=2��CH3COOH��Һ��ˮϡ����V L��pH��lgV�ı仯
��ʾ1 LpH=2��CH3COOH��Һ��ˮϡ����V L��pH��lgV�ı仯
B. ��ʾ��ͬ�¶���ˮ��Һ��H+��OH��Ũ�ȵı仯�����ߣ�ͼ���¶�T2��T1
��ʾ��ͬ�¶���ˮ��Һ��H+��OH��Ũ�ȵı仯�����ߣ�ͼ���¶�T2��T1
C.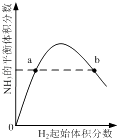 ��ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ���������N2����ʼ���㶨���ı仯��ͼ��a��N2��ת����С��b��
��ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ���������N2����ʼ���㶨���ı仯��ͼ��a��N2��ת����С��b��
D. ��ʾͬһ�¶��£��ڲ�ͬ�ݻ��������н��з�Ӧ2NO2��g��2NO��g��+O2��g����O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
��ʾͬһ�¶��£��ڲ�ͬ�ݻ��������н��з�Ӧ2NO2��g��2NO��g��+O2��g����O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
���𰸡�A
���������⣺A��������������Һ�д��ڵ���ƽ�⣬��ˮϡ��ƽ��������У���ϡ��10n������ҺPH������ֵС��n��ͼ�������������10n����ҺPH����n����λ�����ܱ�ʾ������ƽ��������еı仯��ͼ�����Aѡ��
B��ˮ�ĵ�����������ȹ��̣����ȴٽ�����ƽ��������У�������Ũ����������������Ũ�ȼ�С��һ���¶��´������ӻ��������¶�Խ�������Ӻ�����������Ũ��Խ��T2��T1��ͼ��仯��������Ũ�ȱ仯����B��ѡ��
C�����ַ�Ӧ������һ�ֻ������һ�����ʵ�ת���ʣ��������������������ת������������ͼ��a��N2��ת����С��b�㣬ͼ��仯����ת���ʱ仯����C��ѡ��
D.2NO2��g��2NO��g��+O2��g������Ӧ�������������ķ�Ӧ�����Խ��ѹǿԽС��ƽ���������������ķ������У�������У�����������Ũ��Ӱ�����������ƽ��Ũ�ȼ�С��ͼ��仯���Ϸ�Ӧ�仯����D��ѡ��
��ѡA��
�����㾫�����������������ˮ��Һ�еĵ���ƽ�����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����