��Ŀ����
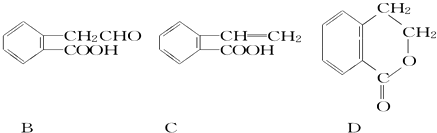
����Ŀ��(1)�����¸����������ʣ�A.��������춡�顡B.���ʯ��ʯī��C60��C.���ɱ���D.35Cl��37Cl��E.NO��NO2�����У���Ϊͬ���칹�����__________(���ţ�����ͬ)����Ϊͬ�����������__________��
(2)���У��ٸɱ����ڽ��ʯ����NH4Cl����Na2S�������ʣ�������Ҫ��ش�(�����)���ۻ�ʱ����Ҫ�ƻ���ѧ������____________���ȴ������Ӽ��ִ��ڹ��ۼ�����____________��
(3)��һ���ݻ�Ϊ2 L���ܱ������г���7 mol SO2��4 mol O2����һ���¶Ⱥ�ѹǿ�£��������·�Ӧ��2SO2(g)��O2(g) 2SO3(g)����4 s��ﵽƽ��״̬�����SO2�����ʵ�����3 mol����ﵽƽ��״̬ʱO2��ת����Ϊ__________��ƽ��ʱSO3�����ʵ���Ũ��_______��
(4) NaBH4(s)��H2O(l)��Ӧ����NaBO2(s)����������25 �桢101 kPa�£���֪ÿ����3.8 g NaBH4(s)����21.6 kJ���÷�Ӧ���Ȼ�ѧ����ʽ��____________________________��
���𰸡� A B �� �� 50% 2 mol��L-1 NaBH4(s)+2H2O(l)==NaBO2(s)+4H2(g) ��H=��216.0kJ��mol-1
��������(1)ͬ���칹����ָ����ʽ��ͬ,���ṹ��ͬ���л�������,��ͬ����������ָ��ͬ��Ԫ����ɵIJ�ͬ������
(2)���Ӿ����ۻ�����Ҫ�ƻ���ѧ��,ԭ�Ӿ����ۻ�ʱ��Ҫ�ƻ����ۼ�,���Ӿ����ۻ�ʱ��Ҫ�ƻ����Ӽ������ۼ�Ϊ�ǽ���ԭ��֮���γɵĻ�ѧ�������Ӽ�Ϊ��������֮���γɵĻ�ѧ�����������ʵ���ɽ����ж���
(3)���ݷ�Ӧ�б仯�����ʵ���֮�ȵ��ڻ�ѧ������֮��,�����Ӧ�����������ʵ���,Ȼ�����ת����=ת����/��ʼ����100%����������ݷ���ʽ,�����SO3�����ʵ���,������c=![]() ���� SO3�����ʵ���Ũ����
���� SO3�����ʵ���Ũ����
(4)n(NaBH4)=![]() =0.1mol, ��25 �桢101 kPa�£���֪ÿ����0.1mol NaBH4(s)����21.6 kJ��������1mol NaBH4����216.0kJ��������ʵ�״̬���ʱ���д�Ȼ�ѧ����ʽ��
=0.1mol, ��25 �桢101 kPa�£���֪ÿ����0.1mol NaBH4(s)����21.6 kJ��������1mol NaBH4����216.0kJ��������ʵ�״̬���ʱ���д�Ȼ�ѧ����ʽ��
���:(1)A����������춡��ķ���ʽ����C4H10,���ṹ��ͬ����Ϊͬ���칹����
B�����ʯ��ʯī��C60������̼Ԫ����ɵ��������ڲ�ͬ�ĵ�������Ϊͬ����������
C�����ɱ��ijɷֱַ���ˮ��������̼�������ֲ�ͬ��������
D��35Cl��37Cl����������ͬ,��������ͬ��ԭ��,��Ϊͬ��Ԫ�صIJ�ͬ����,��Ϊͬλ����
E��.NO��NO2�����ֲ�ͬ��������
��ˣ�������ȷ����:A��B��
(2)���Ӿ����ۻ�����Ҫ�ƻ���ѧ��,�����ۻ�ʱ����Ҫ�ƻ���ѧ���������ɱ���
�ڽ��ʯ����NH4Cl����Na2S�ֱ�����ԭ�Ӿ��塢���Ӿ��塢���Ӿ���,�ۻ�ʱ��Ҫ�ƻ����ۼ������Ӽ������Ӽ���
���ɱ���̼��֮���γɹ��ۼ��������ʯ��̼̼֮���γɹ��ۼ�����NH4Cl�������Ӻ�笠�����֮��������Ӽ���笠������е�ԭ�Ӻ���ԭ��֮����ڹ��ۼ�����Na2S����������������֮���γ����Ӽ���
��ˣ�������ȷ����:�٣��ۣ�
(3)��һ���ݻ�Ϊ2L���ܱ������г���7 mol SO2��4 mol O2����һ���¶Ⱥ�ѹǿ�£��������·�Ӧ��2SO2(g)��O2(g) 2SO3(g)����4s��ﵽƽ��״̬,���SO2�����ʵ�����3mol,��Ӧ��SO2�����ʵ�����4mol,��Ӧ�б仯�����ʵ���֮�ȵ��ڻ�ѧ������֮��,�������ĵ����������ʵ���Ϊ2mol,
ƽ��״̬ʱO2��ת����Ϊ![]() ��100%=50%��
��100%=50%��
�μӷ�Ӧ��SO2�����ʵ���Ϊ7mol-3mol=4mol,���ݷ���ʽ2SO2(g)��O2(g) 2SO3(g)
����֪��,���ɵ�SO3�����ʵ������ڲμӷ�Ӧ��SO2�����ʵ���,
ƽ��ʱSO3�����ʵ���Ũ��Ϊ![]() =2mol/L��
=2mol/L��
��ˣ�������ȷ������50% ��2 mol��L-1 ��
��4��n(NaBH4)=![]() =0.1mol, ��25 �桢101 kPa�£���֪ÿ����0.1mol NaBH4(s)����21.6 kJ��������1mol NaBH4����216.0kJ�����Ȼ�ѧ����ʽΪNaBH4(s)+2H2O(l)==NaBO2(s)+4H2(g) ��H=��216.0kJ��mol-1��
=0.1mol, ��25 �桢101 kPa�£���֪ÿ����0.1mol NaBH4(s)����21.6 kJ��������1mol NaBH4����216.0kJ�����Ȼ�ѧ����ʽΪNaBH4(s)+2H2O(l)==NaBO2(s)+4H2(g) ��H=��216.0kJ��mol-1��
��ˣ�������ȷ����: NaBH4(s)+2H2O(l)==NaBO2(s)+4H2(g) ��H=��216.0kJ��mol-1��