题目内容
7.已知2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
| A. | 2.43kJ | B. | 4.86kJ | C. | 43.8kJ | D. | 87.5kJ |
分析 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,①
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1;②
根据盖斯定律,由$\frac{①+②}{2}$得出正确结论.
解答 解:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,①
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1;②
由$\frac{①+②}{2}$得H2O(g)=H2O(l)△H=$\frac{-571.6kJ•mo{l}^{-1}+484.1kJ•mo{l}^{-1}}{2}$=-87.5kJ•mol-1,
1g气态H2O的物质的量为$\frac{1g}{18g/mol}$=$\frac{1}{18}$mol,故1g气态H2O液化放出的热量是$\frac{1}{18}$mol×(-87.5kJ•mol-1)=4.86kJ,
故选B.
点评 本题考查盖斯定律的应用,难度中等.要注意物质的状态.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,含NA个氩原子的氩气的体积约为11.2 L | |
| B. | 31g白磷分子中,含有的共价单键数目是NA个 | |
| C. | 6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
15.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电能力变化不大的是( )
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 醋酸 | D. | 0.5 mol•L-1 氨水 |
12.可以把6种无色液体:乙醇、苯酚、CCl4、AgNO3溶液、KOH溶液、氢硫酸区分开的试剂是( )
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
19.在一个固定容积的密闭容器中,2molA和1molB发生反应2A(g)+B(g)?3C(g),达到平衡时,C的浓度为W mol/L.维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol/L,该配比是( )
| A. | 4molA+2molB | B. | 1molA+0.5molB+1.5molC | ||
| C. | 3molC+1molB | D. | 3molC+2molA+1molB |
17.现有H2、CO、CH4的混合气体VL,其体积比为1:1:2.当aL该混合气体完全燃烧时,所需相同条件下O2的体积为( )
| A. | $\frac{5V}{4}L$ | B. | 5VL | C. | 5aL | D. | $\frac{5a}{4}L$ |

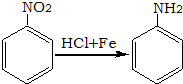
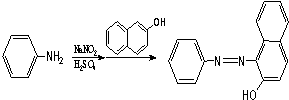
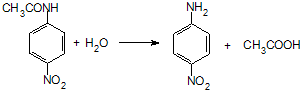 .
. 、F
、F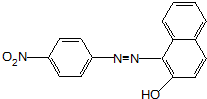 .
. (其中两种).
(其中两种).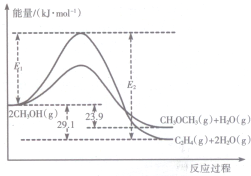 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应: