题目内容
15.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电能力变化不大的是( )| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 醋酸 | D. | 0.5 mol•L-1 氨水 |
分析 溶液混合后导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化.B项中物质均是强电解质,加入NaOH后生成物仍是强电解质,故导电性变化不大;A、C、D项中物质由于难电离,离子浓度很小,当加入NaOH后,离子浓度增大很多,成为强电解质,故导电能力与原来相比变化很大.
解答 解:导电能力的大小,要比较单位体积内离子浓度的多少.
A、因水是极弱的电解质,导电性极弱,加入氢氧化钠后,氢氧化钠是强电解质,溶液中主要的是钠离子和氢氧根,导电性增强,故A错误;
B、未加氢氧化钠固体,导电的有氯离子和氢离子,加入氢氧化钠后主要是钠离子,氯离子,而参加反应的氢离子正好与钠离子的量相当.所以导电性变化不大,故B正确;
C、原来是弱电解质,离子较少,加入强碱以后,变为强电解质,导电能力增强,故C错误;
D、一水合氨是弱电解质,加入NaOH后,溶液中离子的浓度变大,故导电能力增强,故D错误;
故选B.
点评 本题考查溶液中离子浓度大小比较,以此判断溶液的导电性,溶液混合后导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化,题目难度不大.

练习册系列答案
相关题目
5.砷(As)元素与P元素同一主族,下列关于砷(As)元素的叙述不正确的是( )
| A. | 最高价氧化物的化学式为As2O5 | |
| B. | 气态氢化物的稳定性强于磷化氢而弱于硫化氢 | |
| C. | 砷单质在通常状况下为固态 | |
| D. | 砷酸是一种弱酸,酸性比磷酸酸性弱 |
6. 如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )
如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )
 如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )
如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )| A. | 浓盐酸附近产生白烟:NH3与HCl气体反应产生了NH4Cl固体 | |
| B. | 浓硫酸附近无明显现象:NH3与浓硫酸不发生反应 | |
| C. | 氯化物溶液变浑浊:该溶液一定是AlCl3溶液 | |
| D. | 湿润的红色石蕊试纸变蓝:NH3的水溶液显碱性 |
7.已知2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
| A. | 2.43kJ | B. | 4.86kJ | C. | 43.8kJ | D. | 87.5kJ |
5.下列互为同位素的是( )
| A. | D(2H)和T(3H) | B. | 40K和40Ca | C. | O2和O3 | D. | Na和Na+ |
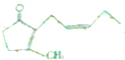 ),其香味浓郁,被广泛应用于化妆品的制造中.
),其香味浓郁,被广泛应用于化妆品的制造中.