题目内容
2.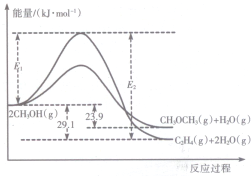 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii、2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ•mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5kJ•mol-1.
分析 (1)如图分析可知,反应的活化能越小反应速率越快,加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变.
(2)分析图象2CH3OH(g)?C2H4(g)+2H2O(g)△H=-29.1KJ/mol,2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.9KJ/mol,CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的热化学方程式可以依据盖斯定律计算得到.
解答 解:(1)反应的活化能越小反应速率越快,在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应中反应i和ii相比,反应i的活化能小,反应速率快,加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化是减小,催化剂不改变反应物总能量与生成物总能量之差即反应热不变,E2-E1的大小为反应的焓变,活化能大小对该反应的反应热无影响,故答案为:ⅰ;该反应的活化能较小;减小;不变;
(2)分析图象得到反应①2CH3OH(g)?C2H4(g)+2H2O(g)△H=-29.1KJ/mol,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.9KJ/mol,
③CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.
依据盖斯定律②-①-③得到乙烯气相直接水合反应的热化学方程式为:C2H4(g)+H2O(g)=C2H5OH(g)△H=-45.5 kJ•mol-1,故答案为:-45.5 kJ•mol-1.
点评 本题考查了化学平衡、平衡常数的影响因素分析判断,注意图象分析和热化学方程式的分析判断,掌握基础是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CH3CH2CH3 | B. | (CH3)3CCH2CH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
| A. | 20% | B. | 33.3% | C. | 50% | D. | 75% |
| A. | 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | |
| B. | 0.1mol/L氯化铵溶液的pH约为5 | |
| C. | 0.1mol/L氨水可以使酚酞试液变红 | |
| D. | 铵盐受热易分解 |
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
| A. | 2.43kJ | B. | 4.86kJ | C. | 43.8kJ | D. | 87.5kJ |
| A. | Na、Cs 是同一主族的元素,所以 NaCl、CsCl晶体的空间结构相似 | |
| B. | HF、HCl、HBr、HI的相对分子质量依次增大,则沸点依次升高 | |
| C. | C、Si均为第ⅣA族元素,则CO2与SiO2的物理性质相似 | |
| D. | NH3分子的价层电子对对数为4,但空间构型为三角锥形 |
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 用pH试纸无法测得某氯水的pH值,因为氯水具有漂白性 | |
| D. | SO2能使紫色KMnO4溶液褪色,是由于其具有漂白性 |
| A. | 开启啤酒后,瓶中立刻泛起大量泡沫 | |
| B. | 实验室中常用排饱和食盐水的方法收集Cl2 | |
| C. | 合成氨工业中不断分离出液氨有利于NH3的生成 | |
| D. | 氯化亚铁溶液久置呈黄色 |