题目内容
17.现有H2、CO、CH4的混合气体VL,其体积比为1:1:2.当aL该混合气体完全燃烧时,所需相同条件下O2的体积为( )| A. | $\frac{5V}{4}L$ | B. | 5VL | C. | 5aL | D. | $\frac{5a}{4}L$ |
分析 发生反应:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,根据体积比计算各自体积,再根据方程式计算需要氧气的体积.
解答 解:H2、CO、CH4的混合气体aL,其体积比为1:1:2,故H2、CO、CH4的体积分别为$\frac{a}{4}$L、$\frac{a}{4}$L、$\frac{a}{2}$L,则:
2 H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
$\frac{a}{4}$L $\frac{a}{8}$L
2 CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2
$\frac{a}{4}$L $\frac{a}{8}$L
CH4+2 O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O
$\frac{a}{2}$L aL
故需要氧气的体积为$\frac{a}{8}$L+$\frac{a}{8}$L+VL=$\frac{5a}{4}$L
故选D.
点评 本题考查混合物计算,侧重考查化学方程式计算,有利于基础知识的巩固,属于易错题目,学生容易利用VL体积进行计算.

练习册系列答案
相关题目
7.已知2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
| A. | 2.43kJ | B. | 4.86kJ | C. | 43.8kJ | D. | 87.5kJ |
8.某同学将盛有25mL一氧化氮、二氧化氮混合气体的量筒倒立于水槽中,反应后气体体积缩小为15mL,则原混合气体中一氧化氮与二氧化氮的体积比是( )
| A. | 2:3 | B. | 3:2 | C. | 4:1 | D. | 1:4 |
5.下列互为同位素的是( )
| A. | D(2H)和T(3H) | B. | 40K和40Ca | C. | O2和O3 | D. | Na和Na+ |
12.下列事实和平衡移动无关的是( )
| A. | 开启啤酒后,瓶中立刻泛起大量泡沫 | |
| B. | 实验室中常用排饱和食盐水的方法收集Cl2 | |
| C. | 合成氨工业中不断分离出液氨有利于NH3的生成 | |
| D. | 氯化亚铁溶液久置呈黄色 |
2.瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图,有关说法正确的是( )


| A. | 电池工作时,Na+向负极移动 | |
| B. | 通氨气的电极1作电池的正极 | |
| C. | 电子由电极2经外电路流向电极1 | |
| D. | 燃料电池的总反应为:4NH3+3O2=2N2+6H2O |
9.下列实验能获得成功的是( )
| A. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| B. | 苯与浓溴水反应制取溴苯 | |
| C. | 向苯酚中加浓溴水观察沉淀 | |
| D. | 1 mol/L CuSO4溶液 2 mL和0.5 mol/L NaOH溶液4 mL 混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
6.下列说法正确的是( )
| A. | 同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子构成的 | |
| C. | 钠原子失去一个电子后,它的电子数与氖原子相同,变成10e-微粒 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们互为同位素 |
17.有机物蒽的结构简式为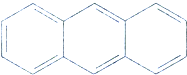 ,它的二溴代物的同分异构体的数目为( )
,它的二溴代物的同分异构体的数目为( )
 ,它的二溴代物的同分异构体的数目为( )
,它的二溴代物的同分异构体的数目为( )| A. | 13 | B. | 14 | C. | 15 | D. | 16 |