题目内容
17.NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 标准状况下,含NA个氩原子的氩气的体积约为11.2 L | |
| B. | 31g白磷分子中,含有的共价单键数目是NA个 | |
| C. | 6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
分析 A.氩气是单原子分子;
B.根据白磷分子的结构,采用均摊法计算出31g白磷含有的共价键数目;
C.根据金刚石的结构,采用均摊法计算出6g金刚石含有的共价键数目;
D.计算出二氧化硅的物质的量,根据1mol硅原子形成了4mol硅氧键分析.
解答 解:A.氩气是单原子分子,标准状况下,含NA个氩原子的氩气的体积约为22.4L,故A错误;
B.31g白磷的含有$\frac{31g}{31g/mol}$=1mol磷原子,白磷为正四面体结构,1个磷原子与其它3个P形成3个P-P共价键,根据均摊法,每个磷原子形成的共价键为:$\frac{1}{2}$×3=1.5,所以1molP可以形成1.5mol共价键,含有的共价单键数目是1.5NA个,故B错误;
C.6g金刚石含有$\frac{6g}{12g/mol}$=0.5mol碳原子,1个碳原子与其它4个C形成4个C-C共价键,根据均摊法,每个碳原子形成的共价键为:$\frac{1}{2}$×4=2,所以0.5mol金刚石可以形成0.5mol×2=1mol共价键,含有的碳碳键数目是6.02×1023,故C错误;
D.4.5g二氧化硅的物质的量为$\frac{4.5g}{60g/mol}$=0.075mol,含有0.075mol硅原子,形成了0.075mol×4=0.3mol硅氧键,含有0.3×6.02×1023个Si-O键,故D正确;
故选D.
点评 本题考查阿伏伽德罗常数的相关计算,难度中等.要注意氩气是单原子分子.

练习册系列答案
相关题目
8.表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
(1)F元素在周期表中的位置是第三周期第ⅢA族.
(2)写出BA4的电子式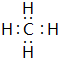 .
.
(3)用电子式表示离子化合物E2D的形成过程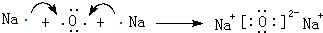 .
.
(4)C和D两种元素氢化物的稳定性更强的是H2O(填物质的化学式).
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
(2)写出BA4的电子式
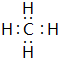 .
.(3)用电子式表示离子化合物E2D的形成过程
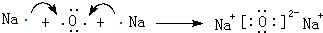 .
.(4)C和D两种元素氢化物的稳定性更强的是H2O(填物质的化学式).
5.砷(As)元素与P元素同一主族,下列关于砷(As)元素的叙述不正确的是( )
| A. | 最高价氧化物的化学式为As2O5 | |
| B. | 气态氢化物的稳定性强于磷化氢而弱于硫化氢 | |
| C. | 砷单质在通常状况下为固态 | |
| D. | 砷酸是一种弱酸,酸性比磷酸酸性弱 |
12.核磁共振氢谱是测定有机分子结构最有用的工具之一.在有机物分子中,不同的氢原子在核磁共振氢谱中给出的峰值(信号)不同.根据峰值(信号)可以确定有机物中氢原子的种类.下列有机物分子中,在核磁共振氢谱中能给出三种信号的是( )
| A. | CH3CH2CH3 | B. | (CH3)3CCH2CH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
2.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的原子半径呈周期性变化 | |
| B. | 元素原子量的递增,量变引起质变 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
9.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石.已知12g石墨完全转化成金刚石时,要吸收1.9kJ的能量.下列说法正确的是( )
| A. | 石墨不如金刚石稳定 | |
| B. | 由金刚石制备石墨是吸热反应 | |
| C. | 等质量的石墨与金刚石完全燃烧,金刚石放出的能量更多 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量更多 |
6. 如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )
如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )
 如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )
如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )| A. | 浓盐酸附近产生白烟:NH3与HCl气体反应产生了NH4Cl固体 | |
| B. | 浓硫酸附近无明显现象:NH3与浓硫酸不发生反应 | |
| C. | 氯化物溶液变浑浊:该溶液一定是AlCl3溶液 | |
| D. | 湿润的红色石蕊试纸变蓝:NH3的水溶液显碱性 |
7.已知2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
| A. | 2.43kJ | B. | 4.86kJ | C. | 43.8kJ | D. | 87.5kJ |
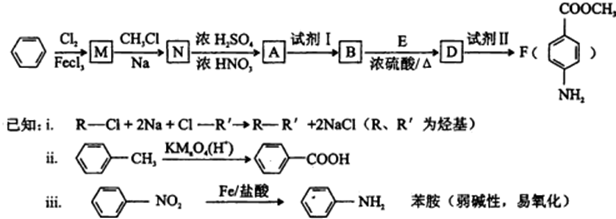
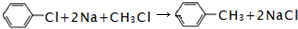 .
.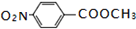 .
. ;
;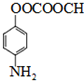 .
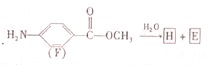
.
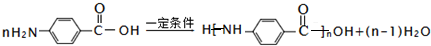 .
.