题目内容
16.CH4和乙醇(C2H6O)在空气中完全燃烧,生成的产物均为CO2和水,试写出它们燃烧的化学方程式,比较相同物质的量的两种燃料耗氧量的大小.分析 CH4和乙醇(C2H6O)在空气中完全燃烧,生成的产物均为CO2和水,根据原子守恒配平方程式;根据方程式判断二者耗氧量的大小.
解答 解:甲烷燃烧生成二氧化碳和水,反应方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;
乙醇(C2H6O)在空气中完全燃烧,生成的产物为CO2和水,反应方程式为:C2H6O+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O;
根据方程式可知:1mol甲烷燃烧消耗2mol氧气;1mol乙醇燃烧消耗3mol氧气;所以相同物质的量的两种燃料完全燃烧,乙醇消耗的氧气多;
答:燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;C2H6O+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O;乙醇消耗的氧气多.
点评 本题考查了有机反应方程式的书写、耗氧量的计算,题目难度不大,注意根据原子守恒书写方程式.

练习册系列答案
相关题目
6.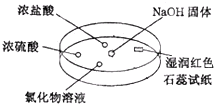 如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )
如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )
 如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )
如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )| A. | 浓盐酸附近产生白烟:NH3与HCl气体反应产生了NH4Cl固体 | |
| B. | 浓硫酸附近无明显现象:NH3与浓硫酸不发生反应 | |
| C. | 氯化物溶液变浑浊:该溶液一定是AlCl3溶液 | |
| D. | 湿润的红色石蕊试纸变蓝:NH3的水溶液显碱性 |
7.已知2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
| A. | 2.43kJ | B. | 4.86kJ | C. | 43.8kJ | D. | 87.5kJ |
11.下列实验操作或所记录的数据合理的是( )
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 用pH试纸无法测得某氯水的pH值,因为氯水具有漂白性 | |
| D. | SO2能使紫色KMnO4溶液褪色,是由于其具有漂白性 |
1.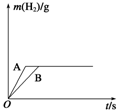 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )| A. | 投入的Na、K的质量一定相等 | |
| B. | 投入的Na的质量小于K的质量 | |
| C. | 曲线A表示Na与盐酸反应,曲线B表示K与盐酸反应 | |
| D. | 该实验能证明K的金属性小于Na的金属性 |
8.某同学将盛有25mL一氧化氮、二氧化氮混合气体的量筒倒立于水槽中,反应后气体体积缩小为15mL,则原混合气体中一氧化氮与二氧化氮的体积比是( )
| A. | 2:3 | B. | 3:2 | C. | 4:1 | D. | 1:4 |
5.下列互为同位素的是( )
| A. | D(2H)和T(3H) | B. | 40K和40Ca | C. | O2和O3 | D. | Na和Na+ |
6.下列说法正确的是( )
| A. | 同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子构成的 | |
| C. | 钠原子失去一个电子后,它的电子数与氖原子相同,变成10e-微粒 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们互为同位素 |