题目内容
12.可以把6种无色液体:乙醇、苯酚、CCl4、AgNO3溶液、KOH溶液、氢硫酸区分开的试剂是( )| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
分析 乙醇和FeCl3溶液无明显现象,苯酚和FeCl3溶液显紫色,CCl4不溶于水,AgNO3溶液和FeCl3溶液有白色沉淀,KOH溶液和FeCl3溶液有红褐色沉淀,氢硫酸和FeCl3溶液发生氧化还原反应生成硫和亚铁离子,现象各不相同,以此来解答.
解答 解:A.乙醇、KOH溶液等不与新制碱性Cu(OH)2悬浊液反应,现象相同,不能鉴别,故A不选;
B.乙醇和FeCl3溶液无明显现象,苯酚和FeCl3溶液显紫色,CCl4不溶于水,AgNO3溶液和FeCl3溶液有白色沉淀,KOH溶液和FeCl3溶液有红褐色沉淀,氢硫酸和FeCl3溶液发生氧化还原反应生成硫和亚铁离子,现象各不相同,可鉴别,故B选;
C.乙醇、苯酚、KOH溶液等不与氯化钡溶液反应,现象相同,不能鉴别,故C不选;
D.乙醇、苯酚均可被酸性高锰酸钾氧化,使其褪色,现象相同,不能鉴别,故D不选;
故选B.
点评 本题考查物质的鉴别,把握物质的性质与反应现象为解答本题的关键,涉及的反应较多,注意氧化还原反应及相互促进水解反应为解答的难点,要注意总结和积累.

练习册系列答案
相关题目
2.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的原子半径呈周期性变化 | |
| B. | 元素原子量的递增,量变引起质变 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
7.已知2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
2H2O(g)=2H2(g)+O2(g)△H=+484.1kJ•mol-1.
1g气态H2O液化放出的热量是( )
| A. | 2.43kJ | B. | 4.86kJ | C. | 43.8kJ | D. | 87.5kJ |
1. 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )| A. | 投入的Na、K的质量一定相等 | |
| B. | 投入的Na的质量小于K的质量 | |
| C. | 曲线A表示Na与盐酸反应,曲线B表示K与盐酸反应 | |
| D. | 该实验能证明K的金属性小于Na的金属性 |
2.瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图,有关说法正确的是( )


| A. | 电池工作时,Na+向负极移动 | |
| B. | 通氨气的电极1作电池的正极 | |
| C. | 电子由电极2经外电路流向电极1 | |
| D. | 燃料电池的总反应为:4NH3+3O2=2N2+6H2O |
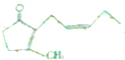 ),其香味浓郁,被广泛应用于化妆品的制造中.
),其香味浓郁,被广泛应用于化妆品的制造中.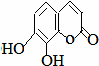 瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.
瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.