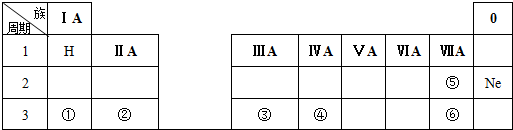
题目内容
4.在密闭容器中的可逆反应CO(g)+NO2(g)?CO2(g)+NO(g)+Q达到平衡后:(1)扩大容器体积,平衡不移动(正向、逆向、不),C(NO2)将减小(增大、减小、不变),反应混合物的颜色变浅(变深、变浅、不变).
(2)升高温度平衡逆向移动(正向、逆向、不),加入催化剂,NO的物质的量不变(增大、减小、不变),原因是催化剂只能缩短反应达平衡的时间.
分析 (1)由于反应前后气体的化学计量数之和相等,减小压强对平衡移动没有影响,但反应物的浓度减小;
(2)由于反应放热,升高温度平衡向逆反应方向移动,催化剂不影响平衡移动,只能加快反应速率.
解答 解:解:可逆反应CO(g)+NO2(g)?CO2(g)+NO(g);△H<0,该反应中,气体的化学计量数之和前后相等,反应放热,则
(1)由于反应前后气体的化学计量数之和相等,压强对平衡移动没有影响,但由于体积增大,气体的物质的量不变,所以反应物的浓度减小,反应混合物的颜色变浅,
故答案为:不;减小;变浅;
(2)由于反应放热,升高温度平衡向逆反应方向移动,催化剂只改变反应速率,但不改变平衡移动,所以加入催化剂对平衡移动无影响,NO2的物质的量不变,催化剂只能缩短反应达平衡的时间,
故答案为:逆向;不变; 催化剂只能缩短反应达平衡的时间.
点评 本题考查化学平衡的影响因素,题目难度中等,解答时首先分析化学方程式的特征,特别是反应前后气体的化学计量数关系以及反应的吸、放热问题.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
14.炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=Q kJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
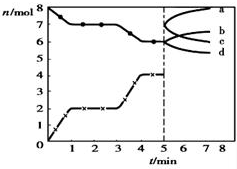

| A. | 1~3min时,v(CO)=v(CO2) | |
| B. | 当容器内的压强不变时,该反应一定达到平衡状态,且$\frac{P(平衡)}{P(开始)}<1$ | |
| C. | 若3min时温度由T1升高到T2,则Q>O,且$\frac{K({T}_{2})}{K({T}_{1})}$=4.7 | |
| D. | 5min时再充入一定量的CO,c、b曲线分别表示n(CO)、n(CO2)的变化 |
15.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A. | 金刚石与石墨互为同位素 | |
| B. | 相同物质的量的石墨具有的能量比金刚石具有的能量高 | |
| C. | 金刚石不如石墨稳定 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
12.能用浓硫酸干燥的气体是( )
| A. | HI | B. | NH3 | C. | SO2 | D. | H2S |
19.下列物质能通过化合反应直接制得的是( )
①Cu2S ②SO3 ③NH4NO3 ④FeS ⑤NH3.
①Cu2S ②SO3 ③NH4NO3 ④FeS ⑤NH3.
| A. | 只有①②③⑤ | B. | 只有①④⑤ | C. | 只有①③④⑤ | D. | 全部 |
9.某芳香烃的分子式为C10H14,不能使溴水褪色,分子结构中只含有一个侧链烃基,则此侧链烃基的结构共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
13.如表除去括号内杂质所用的试剂和方法都正确的是( )
| 选项 | 物质 | 所用试剂 | 方法 |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| B | 乙醇(水) | 生石灰 | 分液 |
| C | 乙醇(乙酸) | 氢氧化钠溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
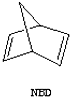 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$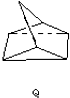 △H=+88.62kJ/mol
△H=+88.62kJ/mol .若用氯原子取代NBD分子中的一个H原子,可得到的同分异构体共有3种.
.若用氯原子取代NBD分子中的一个H原子,可得到的同分异构体共有3种.