题目内容
4.下列说法或表示正确的是( )| A. | NH3、H2O、PCl3都是极性分子 | B. | CO2的分子示意图: | ||
| C. | H2O2的电子式: | D. | CS2、C6H6、C2H2都是直线型分子 |
分析 A.氨气、水和氯化磷都是由极性键形成的极性分子;
B.二氧化碳分子中,碳的原子半径大于氧原子,则碳原子的相对体积应该大于氧原子;
C.过氧化氢属于共价化合物,分子中不存在阴阳离子;
D.苯为平面结构,不是直线型结构.
解答 解:A.NH3、H2O、PCl3分子的共价键都是极性键,分子结构不能将键的极性抵消,所以都是极性分子,故A正确;
B.二氧化碳为直线形结构,分子中存在两个碳氧双键,碳原子相对体积应该大于氧原子,二氧化碳正确的比例模型为: ,故B错误;
,故B错误;
C.H2O2为共价化合物,其电子式为: ,故C错误;
,故C错误;
D.CS2、C2H2为直线形结构,而C6H6为平面结构,故D错误;
故选A.
点评 本题考查了化学用语的判断,题目难度中等,注意掌握电子式、比例模型、常见分子极性及结构,明确双氧水与过氧化钠的电子式的区别,试题侧重考查学生的规范答题能力.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
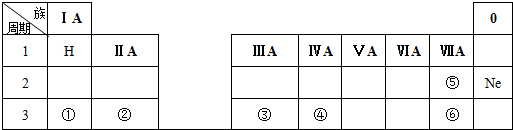
15.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,可用于制半导体材料的元素是Si.
(2)B的最高价氧化物对应的水化物与C的单质反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
(3)最高价氧化物对应的水化物中酸性最强的是HClO4;
(4)A分别与D、E、G、H形成的化合物中,最稳定的是HF;
(5)在B、C、D中,原子半径由大到小的顺序是Na>Al>C.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)B的最高价氧化物对应的水化物与C的单质反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
(3)最高价氧化物对应的水化物中酸性最强的是HClO4;
(4)A分别与D、E、G、H形成的化合物中,最稳定的是HF;
(5)在B、C、D中,原子半径由大到小的顺序是Na>Al>C.
12.化学无处不在,下列与化学有关的说法正确的是( )
| A. | 日常生活中无水乙醇常用于杀菌消毒 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 加热能杀死流感病毒式因为病毒的蛋白质受热变性 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
9.下列有关说法正确的是( )
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 |
17.医学界通过用放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病.关于14C的下列说法中正确的是( )
| A. | 14C原子与C60中普通碳原子的化学性质相同 | |
| B. | 14C原子与14N原子所含中子数相同 | |
| C. | 14C是C60的同素异形体 | |
| D. | 14CO与12CO、13CO是碳元素的三种同位素 |
18.下列烃中,一氯代物的同分异构体数目相同的是( )
①甲基环己烷 ②间二甲苯 ③对二甲苯 ④乙苯⑤2,2-二甲基丁烷.
①甲基环己烷 ②间二甲苯 ③对二甲苯 ④乙苯⑤2,2-二甲基丁烷.
| A. | ②③ | B. | ①④ | C. | ④⑤ | D. | ③⑤ |