题目内容
11.能在水溶液中大量共存的离子组是( )| A. | H+ Fe3+ ClO-Cl- | B. | H+ SO32-Fe2+ NO3- | ||
| C. | Ag+ K+ Cl-SO42- | D. | K+ NH4+Cl- CO32- |
分析 离子之间不反应生成气体、沉淀、弱电解质或发生双水解反应、氧化还原反应的就能大量共存,据此分析解答.
解答 解:A.H+ 和 ClO-生成弱电解质HClO而不能大量共存,故A错误;
B.酸性条件下,SO32-、Fe2+ 和NO3-发生氧化还原反应而不能大量共存,故B错误;
C.Ag+ 和Cl-、SO42-生成沉淀而不能大量共存,故C错误;
D.这几种离子之间不反应,所以能大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高频考点,侧重考查复分解反应、氧化还原反应,明确离子共存条件是解本题关键,易错选项是B.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 实验时酸或碱溅到眼中,应立即用水冲洗,并不断眨眼,不能用手搓揉眼睛 | |
| B. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氨水后滴加KSCN溶液 | |
| C. | 证明钢铁吸收氧腐蚀的方法是:在镀锌铁皮上滴1~3滴含酚酞的饱和食盐水,静置1~2min,观察现象 | |
| D. | 用新制氢氧化铜悬浊液不能鉴别乙醇溶液和葡萄糖溶液 |
2.H、Al、O、N、S是常见的六种元素
(1)S位于元素周期表三周期第VIA族,Fe的基态原子核外价电子排布式为3d64s2(或1s22s22p63s23p63d64s2);O的基态原子核外有8种运动状态不同的电子
(2)用“>”“<”或“=”填空
(3)己知:下列两个热化学方程式:
4Fe(s)+302(g)=2Fe2O3(s)△H=-aKJ/mol
4Al(s)+3O2(g)=2Al2O3(S)△H=-bKJ/mol
則Al(s)的单质和Fe2O3(s)反应的热化学方程式是Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s)△H=-$\frac{1}{2}$(b-a)KJ•mol-1
(4)FeSO4溶液可与硝酸发生反应,写出此反应的离子方程式,并标出电子转移的方向和数目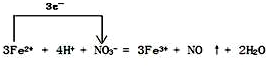 .
.
(1)S位于元素周期表三周期第VIA族,Fe的基态原子核外价电子排布式为3d64s2(或1s22s22p63s23p63d64s2);O的基态原子核外有8种运动状态不同的电子
(2)用“>”“<”或“=”填空
| 第一电离能 | 氧化性 | 沸点 | 非金属性 |
| N>S | Fe3+>Al3+ | NH3<H2O | 16O=18O |
4Fe(s)+302(g)=2Fe2O3(s)△H=-aKJ/mol
4Al(s)+3O2(g)=2Al2O3(S)△H=-bKJ/mol
則Al(s)的单质和Fe2O3(s)反应的热化学方程式是Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s)△H=-$\frac{1}{2}$(b-a)KJ•mol-1
(4)FeSO4溶液可与硝酸发生反应,写出此反应的离子方程式,并标出电子转移的方向和数目
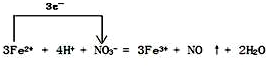 .
.
19.美国康乃尔大学的魏考克斯(C.Wilxox)所合成的一种有机分子,就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机物分子的说法不正确的是( )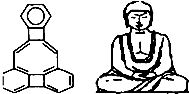

| A. | 该有机物属于苯的同系物 | |
| B. | 1mol该有机物完全燃烧需消耗25molO2 | |
| C. | 该有机物分子中含有21个碳原子 | |
| D. | 该有机物的一氯代物只有6种 |
6.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 同温同压同体积的CO2和SO2所含氧原子数均为2NA | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 1L1.0mol•L-1NH4Cl与2L 0.5mol•L-1NH4Cl溶液含NH4+数目相同 |
16.下列说法正确的是( )
| A. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | NO可用于某些疾病的治疗 | |
| C. | NO2通入FeSO4溶液中始终无明显现象 | |
| D. | 汽车尾气的主要污染成分包括NO、CO和N2 |
3.我国已对酒驾实行了“醉驾入刑”,酒的主要成分是乙醇.则下列说法正确的是( )
| A. | 乙醇分子中的官能团是酚羟基 | |
| B. | 使用K2Cr2O7酸性溶液检测酒驾,是利用了乙醇的氧化性 | |
| C. | 乙醇可以发生取代、消去和氧化反应 | |
| D. | 将75%的乙醇与98%的浓硫酸混合液迅速加热至170°C以制取乙烯 |
 .
.