题目内容
20.(1)等质量的CH4、C2H6、C2H4、C2H2完全燃烧时,消耗氧气由多到少的顺序是CH4、C2H6、C2H4、C2H2(2)等物质的量的CH4、C2H6、C2H4、C2H2完全燃烧时,消耗氧气由多到少的顺序是C2H6、C2H4、C2H2、CH4.
分析 (1)质量相等的条件下,氢原子消耗的氧气大于碳原子消耗的氧气,因此烃分子中,氢元素的含量越多,消耗的氧气就越多,在最简式CHn中,n越大,含氢量越高;
(2)等物质的量时CxHy,消耗氧气由(x+$\frac{y}{4}$)的大小决定.
解答 解:(1)CH4、C2H6、C2H4、C2H2的最简式分别为CH4、CH3、CH2、CH,等质量时氢元素的含量越多,消耗的氧气就越多,则消耗氧气由多到少的顺序是CH4、C2H6、C2H4、C2H2,故答案为:CH4、C2H6、C2H4、C2H2;
(2)设均为1mol,CH4、C2H6、C2H4、C2H2完全燃烧消耗氧气分别为(1+$\frac{4}{4}$)mol、(2+$\frac{6}{4}$)mol、(2+$\frac{4}{4}$)mol、(2+$\frac{2}{2}$)mol,则耗氧气由多到少的顺序是C2H6、C2H4、C2H2、CH4,
故答案为:C2H6、C2H4、C2H2、CH4.
点评 本题考查化学反应方程式的计算,为高频考点,把握烃燃烧的规律为解答的关键,侧重分析与计算能力的考查,不需要书写化学反应即可计算,题目难度不大.

练习册系列答案
相关题目
10.X、Y、Z、W在周期表中的相对位置如图所示,其中X是地壳中含量最多的元素,下列说法正确的是( )

| A. | 原子半径:W>Z>Y>X | |
| B. | W氢化物的沸点比X氢化物的沸点高 | |
| C. | Y元素的周期序数等于主族序数 | |
| D. | Y、Z两元素的最高价氧化物对应的水化物能发生化学反应 |
11.能在水溶液中大量共存的离子组是( )
| A. | H+ Fe3+ ClO-Cl- | B. | H+ SO32-Fe2+ NO3- | ||
| C. | Ag+ K+ Cl-SO42- | D. | K+ NH4+Cl- CO32- |
8.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA | |
| B. | 标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
14.下列晶体熔化时不需要破坏化学键的是( )
| A. | 金刚石 | B. | 氟化镁 | C. | 冰醋酸 | D. | 金属钾 |


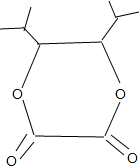 +2H2O;
+2H2O; ;
;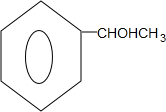 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.