题目内容
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
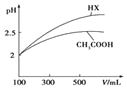
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
【答案】 a BD 大于 稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大 9.9×10-7
【解析】(1)据电离平衡常数可以知道,酸性由强到弱的顺序为:![]() ,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,所以pH由小到大排列顺序是a<d<c<b,正确答案: a<d<c<b 。
,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,所以pH由小到大排列顺序是a<d<c<b,正确答案: a<d<c<b 。
(2) 0.1mol·L-1CH3COOH溶溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,浓度减小,酸性减弱;氢离子浓度减小, A错误;加水稀释过程中,氢离子物质的量增大,醋酸分子物质的量减小,所以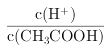 增大,B正确;水的离子积常数不变,C错误;醋酸溶液加水稀释时酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,所以c(OH-)/c(H+)增大,D正确;醋酸的电离平衡常数不变,E错误;正确答案:BD。
增大,B正确;水的离子积常数不变,C错误;醋酸溶液加水稀释时酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,所以c(OH-)/c(H+)增大,D正确;醋酸的电离平衡常数不变,E错误;正确答案:BD。
(3) pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸,所以HX的酸性大于醋酸,则HX的电离平衡常数大于醋酸;正确答案:大于;稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大。
(4) CH3COOH与CH3COONa的混合溶液中,存在电荷守恒: c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(CH3COO-)- c(Na+)= c(H+)- c(OH-)=10-6-10-8=9.9×10-7;正确答案:9.9×10-7。

 中考解读考点精练系列答案
中考解读考点精练系列答案