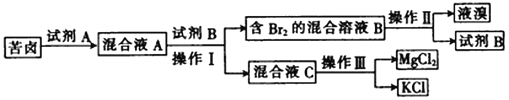
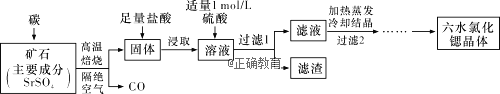
题目内容
【题目】氢能是未来最理想的新能源。
(1)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+_____![]() _____ +_____④2HgO
_____ +_____④2HgO![]() 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________。
(2)已知2H2(g) + O2(g) ==2H2O(l);△H=–571.6 kJ·![]()
C3H8(g) +5O2(g) ==3CO2(g) + 4H2O(l);△H=–2220.0 kJ·![]() ,
,
试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
【答案】 HgBr2+CaO![]() HgO+CaBr2 循环过程需要很高的能量,且使用重金属汞,会产生污染 2.8
HgO+CaBr2 循环过程需要很高的能量,且使用重金属汞,会产生污染 2.8
【解析】(1)理想的原子经济性反应是原材料分子中的原子全部转变成所需产物,不产生副产物,实现零排放.原子利用率是指反应物中的所有原子进入期望产物中的百分比,绿色化学的特征之一是提高原子利用率,尽量达到100%,根据原子经济原则,可知最终反应为:2H2O═2H2↑+O2↑;根据盖斯定律将(①+②+③)×2+④,可知反应③为HgBr2+CaO![]() HgO+CaBr2;该方法中需要750℃,消耗能量高,且有重金属污染;正确答案:HgBr2+CaO
HgO+CaBr2;该方法中需要750℃,消耗能量高,且有重金属污染;正确答案:HgBr2+CaO![]() HgO+CaBr2;循环过程需要很高的能量,且使用重金属汞,产生污染。
HgO+CaBr2;循环过程需要很高的能量,且使用重金属汞,产生污染。
(2)设H2和C3H8的质量均为ag,则根据2H2(g) + O2(g) ==2H2O(l);△H=–571.6 kJ·![]() 反应可知,ag氢气产生的热量:a/2×571.6÷2=142.9a kJ,根据C3H8(g) +5O2(g) ==3CO2(g) + 4H2O(l);△H=–2220.0 kJ·
反应可知,ag氢气产生的热量:a/2×571.6÷2=142.9a kJ,根据C3H8(g) +5O2(g) ==3CO2(g) + 4H2O(l);△H=–2220.0 kJ·![]() 反应可知,ag C3H8产生的热量:a/44×2220=50.45 a kJ,二者产生的热量比值约为:2.8:1;正确答案:2.8。
反应可知,ag C3H8产生的热量:a/44×2220=50.45 a kJ,二者产生的热量比值约为:2.8:1;正确答案:2.8。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
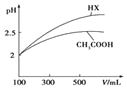
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
【题目】(题文)某实验小组利用如图装置合成氯苯(支撑用的铁架台部分省略)并通过一定操作提纯氯苯。
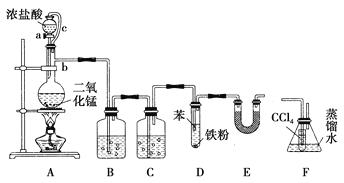
反应物和产物的相关数据列表如下:
密度/g·cm-3 | 沸点/℃ | 水中溶解性 | |
苯 | 0.879 | 80.1 | 微溶 |
氯苯 | 1.11 | 131.7 | 不溶 |
请按要求回答下列问题。
(1)仪器b的名称是________。
(2)A装置中制备Cl2的离子方程式为______________________________。
(3)氯气在通入D之前需净化干燥,则装置C中所加试剂的名称为________。
(4)D中通入氯气后,先看到苯呈黄色,片刻试管液面上方有白雾产生,装置E的作用是________。
(5)为证明氯气和苯发生的是取代反应而不是加成反应,该小组用装置F说明,则装置F置于______之间(填字母),F中小试管内CCl4的作用是________,还需使用的试剂是________。
(6)D中混合物经过滤除铁、加水及NaOH溶液洗涤、无水氯化钙干燥等分离操作后得粗氯苯,粗氯苯中还含有的主要杂质为________,要进一步提纯,下列操作中必需的是________(填入正确选项前的字母)。
A.重结晶 B.分液 C.萃取 D.蒸馏
(7)已知D中加入5 mL苯,经过提纯后收集到氯苯3.0g,则氯苯的产率为________%(保留三位有效数字)。
【题目】温度为T时,向4L恒容密闭容器中充入2 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是 ( )
A. 反应在前50 s的平均速率为v(PCl3)=0.006 4 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入4 mol PCl3、4 mol Cl2,达到平衡时,则此反应的化学平衡常数为0.025
D. 相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)<v(逆)