题目内容
【题目】处于平衡状态的反应2 H2 S(g) ![]() 2H2(g)+S2(g)
2H2(g)+S2(g) ![]() H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,![]() H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
【答案】B
【解析】
试题分析:A.加入催化剂,反应途径将发生改变,但是反应的![]() H不会改变。错误。B.升高温度,正逆反应速率都增大,对于可能反应来说,升高温度,根据平衡移动原理:化学平衡向吸热反应方向移动。由于H2S分解反应是吸热反应,所以平衡正向移动,H2S分解率增大。正确。C.该反应是个反应前后气体体积不等的反应。增大压强,化学平衡气体体积减小的反应方向即向向逆反应方向移动。由于正反应为吸热反应,所以平衡逆向移动将会引起体系温度升高。错误。D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小。压强的影响大于浓度增大的影响,根据平衡移动原理:增大压强,化学平衡向褪去体积减小的方向移动你,即向逆反应方向移动。但平衡移动的趋势是很微弱的,平衡移动只能减弱这种改变,但不能消除这种改变,因此H2的浓度不原来还是增大很多。错误。
H不会改变。错误。B.升高温度,正逆反应速率都增大,对于可能反应来说,升高温度,根据平衡移动原理:化学平衡向吸热反应方向移动。由于H2S分解反应是吸热反应,所以平衡正向移动,H2S分解率增大。正确。C.该反应是个反应前后气体体积不等的反应。增大压强,化学平衡气体体积减小的反应方向即向向逆反应方向移动。由于正反应为吸热反应,所以平衡逆向移动将会引起体系温度升高。错误。D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小。压强的影响大于浓度增大的影响,根据平衡移动原理:增大压强,化学平衡向褪去体积减小的方向移动你,即向逆反应方向移动。但平衡移动的趋势是很微弱的,平衡移动只能减弱这种改变,但不能消除这种改变,因此H2的浓度不原来还是增大很多。错误。

 习题精选系列答案
习题精选系列答案【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
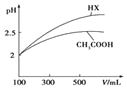
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。

