题目内容
【题目】下列各组变化中,化学反应的反应热前者大于后者的一组是( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1;
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2;
②2H2(g)+O2(g)=2H2O(l)△H1;
H2(g)+O2(g)=H2O(l)△H2
③t℃时,在一定条件下,将1molSO2和1molO2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g)△H1;
CaO(s)+H2O(l)=Ca(OH)2(s)△H2
A. ③④ B. ②③ C. ①② D. ①④
【答案】D
【解析】因![]() 是燃烧反应,反应均放热,
是燃烧反应,反应均放热,![]() Η
Η![]() , CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2;因水由气态变成液态,放出热量,所以△H1>△H2,①正确;②
, CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2;因水由气态变成液态,放出热量,所以△H1>△H2,①正确;②![]() ═
═![]() ;
;![]() ═
═![]() ,氢气的燃烧是放热的,所以焓变是负值,系数加倍,焓变数值也加倍,所以
,氢气的燃烧是放热的,所以焓变是负值,系数加倍,焓变数值也加倍,所以![]() ,所以
,所以![]() ,②错误; t℃时,在一定条件下,将
,②错误; t℃时,在一定条件下,将![]() 和
和![]() 分别置于恒容和恒压的两个密闭容器中,恒压密闭容器相当于在恒容的基础上正向移动了,所以恒P下,达到平衡状态时放出的热量更多,达到平衡状态时放出的热量分别为
分别置于恒容和恒压的两个密闭容器中,恒压密闭容器相当于在恒容的基础上正向移动了,所以恒P下,达到平衡状态时放出的热量更多,达到平衡状态时放出的热量分别为![]() 、
、![]() ,
,![]() ,③错误;
,③错误;![]() ═
═![]() ,
,![]() ═
═![]() ,所以
,所以![]() ,④正确;①④正确;正确选项D。
,④正确;①④正确;正确选项D。

【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
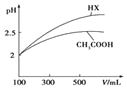
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
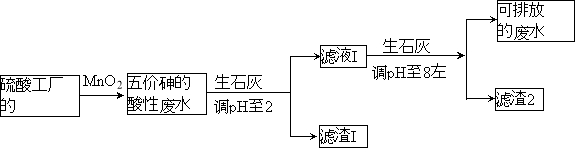
【题目】某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
难溶物 | Ksp |
Ca3(AsO4)2 | 6.8×10-19 |
CaSO4 | 9.1×10-6 |
FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
污染物 | H2SO4 | As |
废水浓度 | 29.4g/L | 1.6g·L-1 |
排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。