题目内容
11.以铬酸钾为原料用电化学法制取重铬酸钾的实验装置如图所示,下列说法不正确的是( )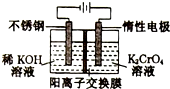
| A. | 电解过程中,K+由阴极室通过阳离子交换膜移阳极室 | |
| B. | 在阴极室,发生的电极反应为:2H++2e-═2H2↑ | |
| C. | 该电解过程实质是电解水 | |
| D. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡2CrO42-(黄色)+2H+?Cr2O32-(橙色)+H2O向右移动 |
分析 酸性条件下,铬酸根离子发生反应2CrO42-(黄色)+2H+?Cr2O32-(橙色)+H2O,用铬酸钾溶液电解制取重铬酸钾,说明阳极室在电解过程中有氢离子生成,
A.电解过程中,阳离子向阴极移动、阴离子向阳极移动;
B.在阴极上氢离子放电生成氢气;
C.阴极上氢离子放电生成氢气,阳极上氢氧根离子放电生成氧气;
D.在阳极室,通电后溶液逐渐由黄色变为橙色,说明阳极室CrO42-和H+反应生成Cr2O32-.
解答 解:酸性条件下,铬酸根离子发生反应2CrO42-(黄色)+2H+?Cr2O32-(橙色)+H2O,用铬酸钾溶液电解制取重铬酸钾,说明阳极室在电解过程中有氢离子生成,
A.电解过程中,阳离子向阴极移动、阴离子向阳极移动,所以K+由阳极室通过阳离子交换膜移阴极室,故A错误;
B.在阴极上氢离子放电生成氢气,电极反应式为2H++2e-═2H2↑,故B正确;
C.阴极上氢离子放电生成氢气,阳极上氢氧根离子放电生成氧气,所以实质上是电解水,故C正确;
D.在阳极室,通电后溶液逐渐由黄色变为橙色,说明阳极室CrO42-和H+反应生成Cr2O32-,则只能是阳极上氢氧根离子放电导致阳极室氢离子浓度增大,从而促进平衡2CrO42-(黄色)+2H+?Cr2O32-(橙色)+H2O向右移动而使溶液变色,故D正确;
故选A.
点评 本题考查电解原理,明确各个电极上发生的反应是解本题关键,侧重考查学生分析判断能力,知道电解质中离子移动方向,题目难度不大.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
1.“玉兔”号月球车用${\;}_{94}^{238}$Pu作为热源材料.下列关于${\;}_{94}^{238}$Pu的说法不正确的是( )
| A. | ${\;}_{94}^{238}$Pu的原子核内中子数为144 | |
| B. | ${\;}_{94}^{238}$Pu的原子核内质子数为94 | |
| C. | ${\;}_{94}^{238}$Pu的原子核外电子数为144 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu的化学性质基本相同 |
2.只有一种试剂可以一次性鉴别(NH4)2SO4、NH4Cl、K2SO4三种溶液,这种试剂是( )
| A. | 盐酸 | B. | 氯化钡溶液 | C. | 氢氧化钡溶液 | D. | 氢氧化钠溶液 |
19.下列不属于低碳经济的是( )
| A. | 太阳能发电 | B. | 火力发电 | C. | 推广节能灯 | D. | 发展核电 |
6.下列说法正确的是( )
| A. | SO2通入碘水中,反应的离子方程式为:SO2+I2+H2O═SO32-+2I-+2H+ | |
| B. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、A102- N03 - | |
| C. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
20.关于我们已学的典型有机物,下列说法中正确的是( )
| A. | 甲烷与氯气混合光照反应后所得产物为4种 | |
| B. | 乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性 | |
| C. | 通入适量的H2可以除去乙烷中混有的乙烯杂质 | |
| D. | 制备乙酸乙酯可用饱和碳酸钠溶液收集 |