题目内容
6.下列说法正确的是( )| A. | SO2通入碘水中,反应的离子方程式为:SO2+I2+H2O═SO32-+2I-+2H+ | |
| B. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、A102- N03 - | |
| C. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
分析 A.碘单质将二氧化硫氧化成硫酸根离子,不是亚硫酸根离子;
B.加入铝粉产生氢气的溶液可能为酸性或碱性溶液溶液,在强碱性溶液中,四种离子不发生反应,能够共存;
C.100℃时,水的离子积大于10-14,pH=2的c(HCl)=0.01mol/L,pH=12的c(NaOH)>0.01mol/L,等体积混合,碱过量;
D.水的电离为吸热反应,升高温度后水的电离程度增大,水的离子积增大.
解答 解:A.SO2通入碘水中,二者发生氧化还原反应,正确的离子方程式为:SO32-+I2+H2O═SO42-+2I-+2H+,故A错误;
B.加入铝粉能产生氢气的溶液中可能为酸性或强碱性溶液,Na+、Ba2+、A102- N03-之间不反应,在强碱性溶液中也不发生反应,能够大量共存,故B正确;
C.100℃时,水的离子积大于10-14,pH=2的盐酸溶液中c(H+)=0.01mol/L,pH=12的NaOH溶液中c(OH-)>0.01mol/L,二者等体积混合,NaOH有剩余,则混合溶液呈碱性,故C错误;
D.升高温度后水的电离程度增大,所以25℃时NH4Cl溶液的KW小于100℃时NH4Cl溶液的KW,故D错误;
故选B.
点评 本题考查了酸碱混合的定性判断、离子方程式的书写、水的电离及其影响、离子共存等知识,题目难度中等,试题知识点较多,充分考查学生灵活应用基础知识的能力,注意掌酸碱混合的定性判断方法,C为易错点,注意温度影响水的电离程度及离子积.

练习册系列答案
相关题目
14.如何除去杂质,提纯下列各物质
| 混合物成分 | 提纯所用试剂的化学式 | 离子方程式 |
| (1)MgO中混有少量Al2O3杂质 | NaOH | Al2O3+2OH-=2AlO2-+H2O |
| (2)FeCl2溶液中混少量FeCl3 | Fe | 2Fe3++Fe=3Fe2+ |
| (3)FeCl3溶液中混少量FeCl2 | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| (4)FeSO4溶液中混少量CuSO4 | Fe | Fe+Cu2+=Cu+Fe2+ |
| (5)NaHCO3溶液中混有少量Na2CO3 | CO2 | CO32-+H2O+CO2=2HCO3- |
| (6)Mg溶液中混有少量Si杂质 | NaOH | 2Si+2OH-+H2O=SiO32-+2H2↑ |
| (7)CO2中混有少量HCl杂质 | NaHCO3 | HCO3-+H+=CO2↑+H2O |
| (8)NaCl溶液中混有少量NaBr | Cl2 | Cl2+2Br-=2Cl-+Br2 |
1.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 向水中加入氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| D. | 将水加热,KW增大,pH不变 |
11.以铬酸钾为原料用电化学法制取重铬酸钾的实验装置如图所示,下列说法不正确的是( )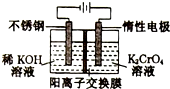

| A. | 电解过程中,K+由阴极室通过阳离子交换膜移阳极室 | |
| B. | 在阴极室,发生的电极反应为:2H++2e-═2H2↑ | |
| C. | 该电解过程实质是电解水 | |
| D. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡2CrO42-(黄色)+2H+?Cr2O32-(橙色)+H2O向右移动 |
18.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,导致测得NaOH溶液浓度偏高的是( )
| A. | 取用NaOH待测液前用少量水洗涤锥形瓶 | |
| B. | 碱式滴定管量取NaOH溶液时,未进行润洗操作 | |
| C. | 摇动锥形瓶时有少量待测液溅出瓶外 | |
| D. | 滴定前滴定管中有气泡,滴定后消失 |
15.取碘水四份分别置于编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ的试管中,再分别加入HCl溶液、酒精、汽油、CCl4,振荡后静置,下列现象描述正确的是( )
| A. | Ⅰ中溶液不分层,溶液由棕黄色变成浅绿色 | |
| B. | Ⅱ中溶液分层,下层呈紫红色 | |
| C. | Ⅲ中溶液分层,下层呈紫红色 | |
| D. | Ⅳ中溶液分层,下层呈紫红色 |
16.下列关于乙烯的叙述中,不正确的是( )
| A. | 乙烯分子结构中6个原子处于同一平面 | |
| B. | 乙烯燃烧时,火焰明亮,同时伴有黑烟 | |
| C. | 乙烯可作香蕉等水果的催熟剂 | |
| D. | 乙烯双键中的一个键可以断裂,容易发生加成反应和取代反应 |
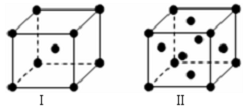 X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子;Y原子核外的L层电子数是K层的两倍;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子.请回答下列问题:
X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子;Y原子核外的L层电子数是K层的两倍;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子.请回答下列问题: