题目内容
19.下列不属于低碳经济的是( )| A. | 太阳能发电 | B. | 火力发电 | C. | 推广节能灯 | D. | 发展核电 |
分析 “低碳经济”指的是生活作息时所耗用的能量要尽量减少,特别是减少二氧化碳的排放量,减缓生态恶化;可以从节电、节能和回收等环节来改变生活细节,据此进行分析判断即可.
解答 解:A.太阳能是清洁能源,能减少二氧化碳的排放,故A错误;
B.火力发电用煤做燃料,加大二氧化碳的排放,不属于低碳经济,故B正确;
C.推广节能灯,能节约用电,能减少二氧化碳的排放,故C错误;
D.核电是清洁能源,能减少二氧化碳的排放,故D错误.
故选B.
点评 本题考查节能减排,难度不大,低碳理念已成为人们的共识,节能减排的措施和观念是化学考查的热点,要用低碳理念指导自己的活动,把节能减排的措施运用到生产、生活中去.

练习册系列答案
相关题目
9.下列离子方程式中,书写不正确的是( )
| A. | 金属钾与水反应:2K+2H2O═2K++2OH-+2H2↑ | |
| B. | 氯气通入碘化钾溶液中:Cl2+2I-═2Cl-+I2 | |
| C. | 铜片放入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 醋酸与碳酸钠溶液反应:2CH3COOH+CO32-═2CH3COO-+H2O+CO2↑ |
10.已知:2NO2+2NaOH-→NaNO3+NaNO2+H2O;NO+NO2+2NaOH-→2NaNO2+H2O.将224mL(标况下)NO和NO2的混合气体溶于20mL NaOH溶液中,恰好完全反应并无气体逸出,则NaOH溶液的物质的量浓度为( )
| A. | 1 mol/L | B. | 0.5mol/L | C. | 0.25mol/L | D. | 0.2mol/L |
7.氯仿(CHCl3,非电解质)在空气中能发生缓慢氧化,生成剧毒物质光气(COCl2),2CHCl3+O2═2COCl2+2HCl.检验氯仿(CHCl3)是否发生氧化还原反应应选用的试剂是( )
| A. | 水 | B. | NaOH溶液 | ||
| C. | 酚酞 | D. | 硝酸酸化的硝酸银溶液 |
14.如何除去杂质,提纯下列各物质
| 混合物成分 | 提纯所用试剂的化学式 | 离子方程式 |
| (1)MgO中混有少量Al2O3杂质 | NaOH | Al2O3+2OH-=2AlO2-+H2O |
| (2)FeCl2溶液中混少量FeCl3 | Fe | 2Fe3++Fe=3Fe2+ |
| (3)FeCl3溶液中混少量FeCl2 | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| (4)FeSO4溶液中混少量CuSO4 | Fe | Fe+Cu2+=Cu+Fe2+ |
| (5)NaHCO3溶液中混有少量Na2CO3 | CO2 | CO32-+H2O+CO2=2HCO3- |
| (6)Mg溶液中混有少量Si杂质 | NaOH | 2Si+2OH-+H2O=SiO32-+2H2↑ |
| (7)CO2中混有少量HCl杂质 | NaHCO3 | HCO3-+H+=CO2↑+H2O |
| (8)NaCl溶液中混有少量NaBr | Cl2 | Cl2+2Br-=2Cl-+Br2 |
4.化学已渗透到人类生活的各个方面.下列说法正确的是( )
| A. | PM2.5含有的铅、镊、铬、钒、砷等对人体有害的元素均是金属元素 | |
| B. | 合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 可以用SiN4、Al2O3,制作高温结构陶瓷制品 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
11.以铬酸钾为原料用电化学法制取重铬酸钾的实验装置如图所示,下列说法不正确的是( )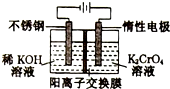

| A. | 电解过程中,K+由阴极室通过阳离子交换膜移阳极室 | |
| B. | 在阴极室,发生的电极反应为:2H++2e-═2H2↑ | |
| C. | 该电解过程实质是电解水 | |
| D. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡2CrO42-(黄色)+2H+?Cr2O32-(橙色)+H2O向右移动 |
8.下表是不同温度下水的离子积数据:
试回答下列问题:
(1)若25<t1<t2,则α>1×10-14(填“>”“<”或“=”),作出此判断的理由是
升高温度,水的电离程度增大,离子积增大.
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关系正确的是AC
A.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α>1×10-14(填“>”“<”或“=”),作出此判断的理由是
升高温度,水的电离程度增大,离子积增大.
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关系正确的是AC
A.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).