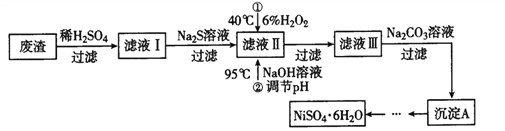
题目内容
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
A.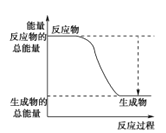 B.
B.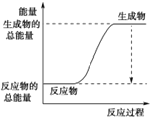
(4)为加快反应速率,可以采取的措施__________。
a.降低温度;b.增大压强;c.恒容时充入He气;d.恒压时充入He气;e.及时分离出NH3
(5)下列可判断反应已达到平衡状态的是__________。
A 气体的平均摩尔质量不变
B N2、H2的反应速率比为1:3
C 混合气体的密度不变
D 生成1mol N2的同时生成2mol NH3
E N2、H2、NH3物质的量之比等于系数比
F 混合气体的总压强不再发生改变
【答案】1.2×10-3 mol·L-1·s-1 30% 46 A b ADF
【解析】
(1)图表中0~50s内氨气的浓度变化为0.24mol,可以计算氨气的反应速率,再根据速率之比等于化学方程式计量数之比计算氮气的反应速率;
(2)250s时,氨气生成的物质的量为0.40mol,则反应的氢气物质的量=0.6mol,由此计算氢气的转化率;
(3)反应焓变△H=反应物总键能-生成物总键能;依据焓变判断反应图像的变化;
(4)升高温度、增大压强、增大浓度、加入催化剂、增加接触面积等措施都可以加快反应速率;
(5)根据化学平衡的定义判断反应是否达到平衡状态。
(1)图表中0~50s内氨气的浓度变化为0.24mol,计算氨气的反应速率v(NH3)= =0.0024mol/(Ls),v(NH3)∶v(N2)=2∶1,v(N2)=
=0.0024mol/(Ls),v(NH3)∶v(N2)=2∶1,v(N2)=![]() =1.2×10-3mol/(Ls),故答案为:1.2×10-3mol/(Ls);
=1.2×10-3mol/(Ls),故答案为:1.2×10-3mol/(Ls);
(2)250s时,生成氨气的物质的量为0.40mol,则反应的氢气的物质的量为0.6mol,转化率=![]() ×100%=30%,故答案为:30%;
×100%=30%,故答案为:30%;
(3)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,N2(g)+3H2(g)2NH3(g),生成1molNH3反应过程中能量变化=![]() ×946kJ/moL+
×946kJ/moL+![]() ×436kJ/mol-3×391kJ/mol=-46kJ/mol,则生成1molNH3过程中的热量变化位46kJ,反应为放热反应,反应物能量高于生成物的能量,反应为放热反应,正确表示该反应中能量变化的是选A,故答案为:46;A;
×436kJ/mol-3×391kJ/mol=-46kJ/mol,则生成1molNH3过程中的热量变化位46kJ,反应为放热反应,反应物能量高于生成物的能量,反应为放热反应,正确表示该反应中能量变化的是选A,故答案为:46;A;
(4)a.降低温度,反应速率减小,故a错误;b.增大压强,反应速率增大,故b正确;c.恒容时充入He气,总压增大,分压不变,反应速率不变,故c错误;d.恒压时充入He气,体积增大,压强减小,反应速率减小,故d错误;e.及时分离NH3,氨气的浓度减小,反应速率减小,故e错误;故答案为:b;
(5)A.反应前后气体质量不变,气体物质的量减小,根M=![]() 可知,平均相对分子质量是变量,混合气体的平均相对分子质量保持不变,说明达到平衡状态,故A选;B.根据方程式,N2、H2的反应速率比始终为1:3,N2、H2的反应速率比为1:3不能说明达到平衡状态,故B不选;C.反应前后气体质量不变、体积不变,根据ρ=
可知,平均相对分子质量是变量,混合气体的平均相对分子质量保持不变,说明达到平衡状态,故A选;B.根据方程式,N2、H2的反应速率比始终为1:3,N2、H2的反应速率比为1:3不能说明达到平衡状态,故B不选;C.反应前后气体质量不变、体积不变,根据ρ=![]() 可知,密度是恒量,混合气体的密度保持不变,不一定达到平衡状态,故C不选;D.生成1mol N2的同时一定分解2mol NH3,因此生成1mol N2的同时生成2mol NH3,说明正逆反应速率相等,达到平衡状态,故D选;E. N2、H2、NH3物质的量之比等于系数比,不能说明三者的物质的量不变,不能说明达到平衡状态,故E不选;F. 反应前后气体物质的量是变量,即反应过程中混合气体的总压强为变量,总压强不再发生改变,说明达到平衡状态,故F选;故答案为:ADF。
可知,密度是恒量,混合气体的密度保持不变,不一定达到平衡状态,故C不选;D.生成1mol N2的同时一定分解2mol NH3,因此生成1mol N2的同时生成2mol NH3,说明正逆反应速率相等,达到平衡状态,故D选;E. N2、H2、NH3物质的量之比等于系数比,不能说明三者的物质的量不变,不能说明达到平衡状态,故E不选;F. 反应前后气体物质的量是变量,即反应过程中混合气体的总压强为变量,总压强不再发生改变,说明达到平衡状态,故F选;故答案为:ADF。

 名校课堂系列答案
名校课堂系列答案