题目内容
【题目】工业上可利用“甲烷蒸气转化法”生产氢气,反应的热化学方程式为CH4(g)+H2O(g)CO2(g)+3H2(g) △H=+161.1kJ·mol-1
(1)已知温度、压强对甲烷平衡时的体积分数的影响如图1,请回答:

①图1中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷体积分数的曲线,其中表示1MPa的是_____。
②该反应的平衡常数:K(600℃)___(填“>”“<”或“=”)K(700℃)。
(2)①已知:在700℃、1MPa时,1molCH4与1molH2O在1L的密闭容器中反应,6min时达到平衡(如图2),此时CH4的转化率为__,该温度下反应的平衡常数为____(结果保留小数点后一位数字)。
②从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是____(填“向正反应方向”或“向逆反应方向”)移动,采取的措施可能是____。
【答案】a < 80% 276.5 向逆反应方向 将容器体积缩小为原来的1/2或加入原平衡等量的氢气
【解析】
(1)根据外界条件对平衡状态的影响分析;
(2)①结合图像和三段式计算CH4的转化率和该温度下反应的平衡常数;
②根据压强对平衡状态的影响分析解答。
(1)①由CH4(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,甲烷的平衡含量会逐渐减小,因此排除曲线c、d,又因增大压强,平衡逆向移动,甲烷的平衡含量增大,故1Mpa是曲线a,2Mpa的是曲线b;
CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,甲烷的平衡含量会逐渐减小,因此排除曲线c、d,又因增大压强,平衡逆向移动,甲烷的平衡含量增大,故1Mpa是曲线a,2Mpa的是曲线b;
②由CH4(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,平衡常数增大,因此该反应的平衡常数:600℃时小于700℃;
CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,平衡常数增大,因此该反应的平衡常数:600℃时小于700℃;
(2)① CH4(g)+H2O(g)![]() CO2(g)+3H2(g)
CO2(g)+3H2(g)
起始(mol/L):1 1 0 0
变化(mol/L):0.8 0.8 0.8 2.4
平衡(mol/L):0.2 0.2 0.8 2.4
此时CH4的转化率为![]() ×100%=80%;
×100%=80%;
该温度下反应的平衡常数K=![]() =276.5mol2L-2;
=276.5mol2L-2;
②由图2可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的![]() 或增加了等量的氢气,无论是增大压强,还是增大氢气的浓度,平衡均是逆向移动。
或增加了等量的氢气,无论是增大压强,还是增大氢气的浓度,平衡均是逆向移动。

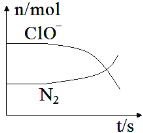
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
A. B.
B.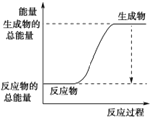
(4)为加快反应速率,可以采取的措施__________。
a.降低温度;b.增大压强;c.恒容时充入He气;d.恒压时充入He气;e.及时分离出NH3
(5)下列可判断反应已达到平衡状态的是__________。
A 气体的平均摩尔质量不变
B N2、H2的反应速率比为1:3
C 混合气体的密度不变
D 生成1mol N2的同时生成2mol NH3
E N2、H2、NH3物质的量之比等于系数比
F 混合气体的总压强不再发生改变
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性溶液中分解产生S、SO2。
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得,实验室模拟该工业过程的装置如图所示。

(1)b中反应的离子方程式为____,c中试剂为_____。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____。
(3)实验中要控制SO2生成速率,可以采取的措施有______(写出两条)。
(4)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是____。
(5)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:_____。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)
Fe(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O32-
装置 | 编号 | 试剂X | 实验现象 |
| ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色, 30s后溶液几乎变为无色 |
② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(6)根据实验①的现象,初步判断最终Fe3+被S2O32-还原为Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____。
(7)同浓度氧化性:Ag+ > Fe3+。实验②中Ag+未发生氧化还原反应的原因是____。
(8)进一步探究Ag+和S2O32-反应。
装置 | 编号 | 试剂X | 实验现象 |
| ③ | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:Ag2S2O3+___=Ag2S+___
(9)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和___有关(写出两条)。