题目内容
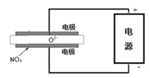
【题目】某同学设计以下实验方案,从海带中提取I2。

(1)操作①的名称是______。
(2)向滤液中加入双氧水的作用是______。
(3)试剂a可以是______(填序号)。
①四氯化碳 ②苯 ③酒精 ④乙酸
(4)I–和IO3-在酸性条件下生成I2的离子方程式是________________。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是____________。
【答案】过滤 将I-氧化为I2 ①② 5I-+IO3-+6H+=3I2+3H2O 富集碘元素
【解析】
分离难溶性固体与可溶性液体混合物的方法为过滤。海带灰中含KI,该物质容易溶于水,具有还原性,在酸性条件下被H2O2氧化为I2,I2容易溶于有机溶剂而在水中溶解度较小,可以通过萃取作用分离碘水。向含有I2的有机物中加入NaOH溶液,发生歧化反应反应生成碘化钠、碘酸钠,进入到水溶液中,向其中加入稀硫酸酸化,I-、IO3-、H+发生反应产生I2的悬浊液,过滤,分离得到粗碘。
(1)操作①是分离难溶性固体与可溶性KI水溶液的操作方法,名称是过滤;
(2)向滤液中加入双氧水的作用是将I-氧化为I2;
(3)试剂a是从I2的水溶液中分离得到I2,可以根据I2容易溶于有机溶剂苯、四氯化碳中溶解度大而在水中溶解度较小,苯或四氯化碳与水互不相容,且与I2不反应的性质,通过萃取分离得到,因此可以是四氯化碳、苯,而不能使用与水互溶的或容易溶于水的乙醇、乙酸,故合理选项是①②;
(4)I–和IO3-在酸性条件下生成I2和水,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式是5I-+IO3-+6H+=3I2+3H2O;
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是提高I2的浓度,达到富集碘元素的目的。

 每课必练系列答案
每课必练系列答案【题目】有四种短周期元素,相关信息如下表。
元素 | 相关信息 |
A | 气态氢化物极易溶于水,可用作制冷剂 |
B | 单质的焰色反应为黄色 |
C | 单质是黄绿色气体,可用于自来水消毒 |
D | –2价阴离子的电子层结构与Ar原子相同 |
请根据表中信息回答:
(1)A在周期表中位于第______周期______族。
(2)用电子式表示B与C形成化合物的过程:______。
(3)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是(填化学式)______。
(4)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是______。
a.其单质在常温下呈固态
b.SeO2既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO3
d.非金属性比C元素的强
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
A.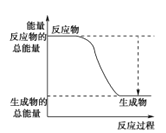 B.
B.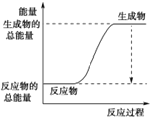
(4)为加快反应速率,可以采取的措施__________。
a.降低温度;b.增大压强;c.恒容时充入He气;d.恒压时充入He气;e.及时分离出NH3
(5)下列可判断反应已达到平衡状态的是__________。
A 气体的平均摩尔质量不变
B N2、H2的反应速率比为1:3
C 混合气体的密度不变
D 生成1mol N2的同时生成2mol NH3
E N2、H2、NH3物质的量之比等于系数比
F 混合气体的总压强不再发生改变