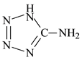
题目内容
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)为原料获得。有关工艺流程如下:
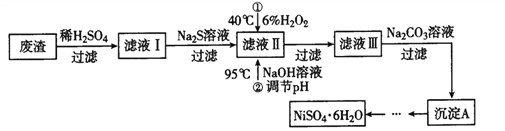
注:(1)NiCO3是一种不溶于水、易溶于强酸的浅绿色沉淀。
(2)25℃,Ksp[Fe(OH)3]=2.64×10-39;溶液中离子浓度小于10-5mol·L-1,可视为沉淀完全。
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_________________。(任写一点)
(2)在滤液Ⅱ中加入H2O2时,温度不能太高的原因是______________________。
(3)滤液Ⅲ中溶质的主要成分是__________________ ,检验滤液Ⅲ中是否还有铁元素的方法是_______________________。
(4)除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠 [Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法正确的是__________________(选填序号)。
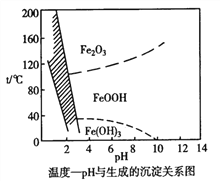
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-27mol·L-1
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH为1.5左右
(5)从“沉淀A”制得NiSO4·6H2O晶体的实验步骤依次为:_________________,用少量乙醇洗涤NiSO4·6H2O晶体并晾干。(实验中须使用的试剂有:6mol·L-1的H2SO4溶液,蒸馏水)
【答案】加热、搅拌、增大硫酸浓度等 防止H2O2受热分解 Na2SO4 、NiSO4 取滤液Ⅲ少许于试管中,滴加KSCN溶液,若不出现血红色,则已除尽 cd 用蒸馏水洗涤沉淀2~3次(1分);向沉淀中加6mol/L的H2SO4溶液,直至恰好完全溶解;蒸发浓缩至有晶膜出现,停止加热,冷却结晶, 过滤得NiSO4·6H2O晶体
【解析】
(1)用稀硫酸溶解废渣时,为了提高废渣浸出率就可以采取加快化学反应速率的方法,如采取升高反应温度,增大硫酸浓度,或在反应过程中不断搅拌,或矿石粉碎等方法提高废渣浸出率 。故本题答案:加热、搅拌、增大硫酸浓度等。
(2)在滤液Ⅱ中加入H2O2 时,温度不能太高的原因是H2O2受热分解成水和氧气,失去了氧化性,所以温度不能太高。目的是防止H2O2受热分解。
(3)废渣(除含镍外,还含有Cu、Fe、Zn等杂质),在硫酸溶解过滤后除去不溶于硫酸的铜,所以滤液含有二价铁离子、三价铁离子、锌离子杂质,加![]() 是将二价铁氧化成三价铁,再通过调节PH值使三价铁和Z锌都以氢氧化物的沉淀而除去,滤液Ⅱ含有可溶性硫酸盐,为
是将二价铁氧化成三价铁,再通过调节PH值使三价铁和Z锌都以氢氧化物的沉淀而除去,滤液Ⅱ含有可溶性硫酸盐,为![]() 、
、![]() ,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成
,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成![]() 在经过过滤得滤液Ⅲ,所以滤液Ⅲ中溶质的主要成分是 Na2SO4 、NiSO4
在经过过滤得滤液Ⅲ,所以滤液Ⅲ中溶质的主要成分是 Na2SO4 、NiSO4
检验滤液Ⅲ存在铁元素的是检验Fe3+,其方法是:取滤液Ⅲ少许于试管中,滴加KSCN溶液,若不出现血红色,则已除尽。此题答案:取滤液Ⅲ少许于试管中,滴加KSCN溶液,若不出现血红色,则已除尽。
(4)FeOOH中铁是+3价,a错误。pH=4,c(OH-)=1×10-10 mol·L-1,c(Fe3+)=![]() =2.64×10-29 mol·L-1,b错误。c项符合电荷守恒、得失电子守恒等守恒关系,也符合反应的酸碱性,正确。观察图象可知d正确。本题答案:c d。
=2.64×10-29 mol·L-1,b错误。c项符合电荷守恒、得失电子守恒等守恒关系,也符合反应的酸碱性,正确。观察图象可知d正确。本题答案:c d。
(5)将NiCO3沉淀转化为NiSO4,要先通过过滤并用蒸馏水洗净沉淀,再向沉淀中加6 mol/L的H2SO4溶液,直至恰好完全溶解之后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥。从“沉淀A”制得NiSO4·6H2O晶体的实验步骤依次为: 用蒸馏水洗涤沉淀2~3次;向沉淀中加6mol/L的H2SO4溶液,直至恰好完全溶解;蒸发浓缩至有晶膜出现,停止加热,冷却结晶, 过滤得NiSO4·6H2O晶体。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
A.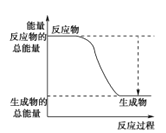 B.
B.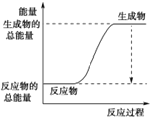
(4)为加快反应速率,可以采取的措施__________。
a.降低温度;b.增大压强;c.恒容时充入He气;d.恒压时充入He气;e.及时分离出NH3
(5)下列可判断反应已达到平衡状态的是__________。
A 气体的平均摩尔质量不变
B N2、H2的反应速率比为1:3
C 混合气体的密度不变
D 生成1mol N2的同时生成2mol NH3
E N2、H2、NH3物质的量之比等于系数比
F 混合气体的总压强不再发生改变