题目内容
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是 ( )
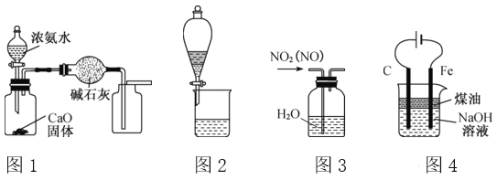
A. 用图1装置制取并收集干燥纯净的NH3
B. 用图2所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
C. 用图3所示装置可除去NO2中的NO
D. 用图4装置制备Fe(OH)2并能较长时间观察其颜色
【答案】B
【解析】
A. 氨气密度比空气小,应用向下排空气法收集。
B. 乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离。
C. 二氧化氮和水反应生成硝酸和一氧化氮。
D. 本装置为电解池,铁连接电源正极,通电才能发生氧化反应。
A.氨气密度比空气小,应用向下排空气法收集,A错误。
B.乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离,B正确。
C.二氧化氮和水反应生成硝酸和一氧化氮,不能除去NO2中的NO,C错误。
D.本装置为电解池,铁连接在电源负极,铁不能发生氧化反应生成亚铁离子,故不能制备氢氧化亚铁,D错误。

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
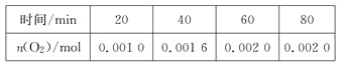
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大