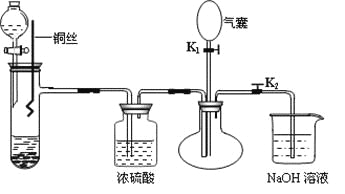
题目内容
【题目】盐酸,硫酸和硝酸是中学阶段常见的“三大酸”。现就“三大酸”与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与![]() 反应,若在稀盐酸中加入
反应,若在稀盐酸中加入![]() 溶液(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为________。
溶液(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为________。
(2)在一定体积的![]() 的浓硫酸中加入过量铜片,加热使之反应。被还原的硫酸为
的浓硫酸中加入过量铜片,加热使之反应。被还原的硫酸为![]() 。则浓硫酸的实际体积________(填“大于”“等于”或“小于”)
。则浓硫酸的实际体积________(填“大于”“等于”或“小于”)![]() 。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如
。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如![]() 溶液),则该反应的离子方程式为________。
溶液),则该反应的离子方程式为________。
(3)根据下图操作及现象推断酸X是________(填字母)。
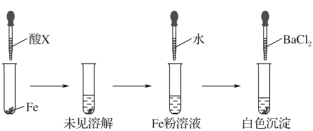
A.浓盐酸 B.浓硫酸 C.浓硝酸
【答案】![]() 大于
大于 ![]() B
B
【解析】
(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化,方程式为:![]() ,
,
故答案为:![]() ;
;
(2)铜只能和浓硫酸反应同稀硫酸不反应,![]() ,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则10molL-1的浓硫酸的实际体积要大于180mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,因溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将铜溶解,反应实质为:
,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则10molL-1的浓硫酸的实际体积要大于180mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,因溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将铜溶解,反应实质为:![]() ,
,
故答案为:大于;![]() ;
;
(3)因浓硫酸在常温下能使金属铁发生钝化,而稀硫酸能与铁发生反应,因最终向铁粉溶液中加入BaCl2会产生白色沉淀,故该溶液中含有SO42-,所以根据现象,可推断酸X为浓硫酸,
故选:B。

【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
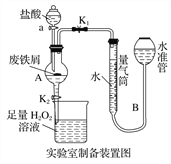
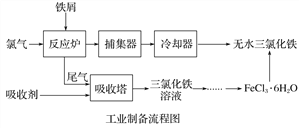
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应。
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸;
Ⅱ.当……时,关闭弹簧夹K1,打开活塞K2,当A中溶液完全进入烧杯后关闭活塞a;
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是_____________________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________。
(3)从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是加入______________后__________________、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:______________________。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式(相对原子质量:Cl-35.5、Fe-56)为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100 mL溶液;取出10.00 mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol·L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-=2I-+S4O62-)。
①滴定终点的现象是________________________________________________;
②样品中氯化铁的质量分数为__________________________。
【题目】下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )
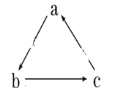
物质 | a | b | c |
A | Al2O3 | AlCl3 | Al(OH)3 |
B | NaAlO2 | Al(OH)3 | AlCl3 |
C | CO2 | NaHCO3 | Na2CO3 |
D | Na | Na2O | Na2O2 |
A.AB.BC.CD.D