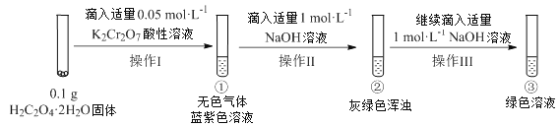
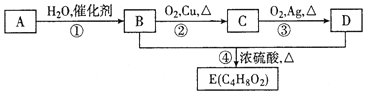
题目内容
【题目】I 锰元素的化合物在多个领域中均有重要应用。
(1)Mn2+基态核外电子排布式为___,SO32-分子的空间构型为____。
(2)二价锰的3种离子化合物MnCl2、MnS、MnO中晶格能最大的是___。
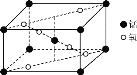
(3)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为___。
(4)在配离子[Mn(CN)6]3-中存在的作用力有___(填字母)。
a. 离子键 b. 共价键 c. 配位键 d. 氢键
II 铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)铜与N2O4在一定条件下可制备无水Cu(NO3)2。
①基态Cu的电子排布式为___。
②与NO3-互为等电子体的一种分子为__(填化学式)。
(2)邻氨基吡啶(![]() )的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
)的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
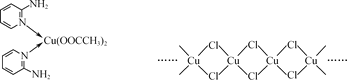
①C、N、O三种元素的第一电离能由大到小的顺序为___。
②邻氨基吡啶的铜配合物中,C原子轨道杂化类型为___。
③1mol![]() 中含有σ键的数目为___mol。
中含有σ键的数目为___mol。
【答案】1s22s22p63s23p63d5 三角锥形 MnO MnO2 bc 1s22s22p63s23p63d104s1或[Ar]3d104s1 SO3或BF3 N>O>C sp2、sp3 13
【解析】
I (1)Mn为25号元素,Mn2+基态核外电子排布式为1s22s22p63s23p63d5;
SO32-中S原子价层电子对=3+![]() (6+2-3×2)=4,且有一个孤电子对,所以其空间构型是三角锥型;
(6+2-3×2)=4,且有一个孤电子对,所以其空间构型是三角锥型;
(2)三种物质都是离子晶体,离子半径越小,离子键就越强,离子晶体的晶格能就越大,物质的熔点就越高,根据表格数据可知上表三种物质中晶格能最大的是MnO;
(3)由图可知,晶胞中Mn原子位于体心与顶点上,O原子位于上下两个面上及体内(有2个),故晶胞中Mn元素数目1+8×![]() = 2、O原子数目2+4×
= 2、O原子数目2+4×![]() =4,故答案为: MnO2;
=4,故答案为: MnO2;
(4)在配离子[Mn(CN)6]3-中,Mn2+与CN-间形成配位键,C与N之间形成共价键,
答案选bc;
II(1)①Cu是29号元素,其原子核外有29个电子,根据构造原理可知铜原子核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
②原子数和价电子数分别都相等的粒子互为等电子体,则与NO3-互为等电子体的一种分子为SO3或BF3;
(2)①同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O>C;
②形成配位键的N原子,没有孤电子对,杂化轨道数目为3,N原子采取sp2杂化,而氨基中N原子形成3个σ键、还有1对孤电子对,N原子杂化轨道数目为4,N原子采取sp3杂化;
③![]() 分子中含有4个C-H键、2个N-H键,2个C-N键,1个C一N键,2个C-C键,2个C一C键,分子中含有13个σ键,1mol 含有σ键的数目为13mol。
分子中含有4个C-H键、2个N-H键,2个C-N键,1个C一N键,2个C-C键,2个C一C键,分子中含有13个σ键,1mol 含有σ键的数目为13mol。

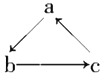
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大