题目内容
6.已知:H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.0×10-11(1)请写出H2CO3第一步电离的电离方程式H2CO3?HCO3-+H+,K2的表达式是K2=$\frac{c({H}^{+})•c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{2-})}$
(2)计算常温时,0.1mol/L的Na2CO3溶液CO32-中的水解常数(忽略第二步水解)Kh=2.5×10-4mol/L,溶液的pH=11.7.
分析 (1)H2CO3是二元弱酸,分两步电离;
(2)根据Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{K}_{w}}{{K}_{2}}$计算;根据Kh表达式计算c(OH-),再计算pH.
解答 解:(1)H2CO3是二元弱酸,分两步电离,第一步电离方程式为:H2CO3?HCO3-+H+,第二步电离方程式为:HCO3-?CO32-+H+,则K2的表达式是K2=$\frac{c({H}^{+})•c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{2-})}$;
故答案为:H2CO3?HCO3-+H+;$\frac{c({H}^{+})•c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{2-})}$;
(2)Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{K}_{w}}{{K}_{2}}$=$\frac{1{0}^{-14}}{4×1{0}^{-11}}$=2.5×10-4mol/L;Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{c}^{2}(O{H}^{-})}{0.1mol/L}$=2.5×10-4mol/L,则c(OH-)=5×10-3mol/L,所以c(H+)=2×10-12mol/L,则pH=11.7,
故答案为:2.5×10-4mol/L;11.7.
点评 本题考查了弱电解质的电离、电离平衡常数的表达式、水解常数的表达式及计算等,题目难度中等,侧重于考查学生对基础知识的应用能力和计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案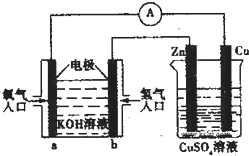
| A. | 一段时间后锌片质量减少 | |
| B. | 该装之中Cu极为正极 | |
| C. | b极的电极反应式:H2-2e-═2H+ | |
| D. | 当铜片的质量变化为12.8g时,a极上消耗的 O2在标况下的体积为2.24L |
| A. | 在常温常压下,11.2L N2含有的分子数为NA | |
| B. | 标准状况下,18g H2O所占的体积约是22.4L | |
| C. | 32gO2在标准状况下所占的体积约为22.4L | |
| D. | 1mol Ne中约含有6.02×1024个电子 |
| A. | Fe→Fe3+ | B. | CO2→CO | C. | Na2O2→O2 | D. | CuO→Cu2+ |
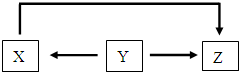
| A. | 若Y为氧化铝,则Y 生成X的条件是“通电” | |
| B. | 若X为硫单质,则Y 可能为硫化氢 | |
| C. | 若Z为硝酸,则X可能为一氧化氮 | |
| D. | 若Z为硝酸铁,则Y一定为铁单质 |
| A. | 木炭在氧气中燃烧,产生大量白烟 | |
| B. | 红磷在空气中燃烧,产生苍白色火焰 | |
| C. | 镁条在空气中燃烧发出耀眼白光,生成黑色固体 | |
| D. | 硫在氧气中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体 |
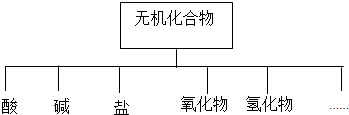
(1)如图所示的物质分类方法名称是树状分类法.
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、④、⑥、⑩后面.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO4 ⑥ | ⑦SO2 ⑧SO3 | ⑨NH3 ⑩ |
⑤在水中电离方程式为:Na2SO4=2Na++SO42-
(4)上述物质中⑦与足量③溶液反应的离子反应方程式为:SO2+2OH-═H2O+SO32-.

 .
.