题目内容
16.无机化合物可根据其组成和性质进行分类,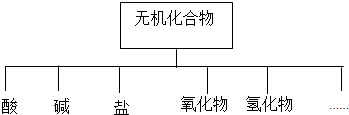
(1)如图所示的物质分类方法名称是树状分类法.
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、④、⑥、⑩后面.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO4 ⑥ | ⑦SO2 ⑧SO3 | ⑨NH3 ⑩ |
⑤在水中电离方程式为:Na2SO4=2Na++SO42-
(4)上述物质中⑦与足量③溶液反应的离子反应方程式为:SO2+2OH-═H2O+SO32-.
分析 (1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树;
(2)酸电离出的阳离子全部是氢离子的化合物;碱电离出的阴离子全部为氢氧根离子;盐电离出得阳离子为金属离子,阴离子为酸根离子;
(3)电解质是指在水溶液或是熔融状态下能导电的化合物,根据电离方程式的书写方法来回答;
(4)二氧化硫是酸性氧化物,可以和碱反应生成盐和水.
解答 解:(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有叶、枝、杆、根,图示方法就是树状图,故答案为:树状分类法;
(2)酸电离出的阳离子全部是氢离子的化合物,如H2SO4、H2SO3、HNO3;碱电离出的阴离子全部为氢氧根离子,如KOH、NH3.H2O;盐电离出得阳离子为金属离子,阴离子为酸根离子,如Na2SO3、NaNO3,H2O属于氧化物.
故答案为:HNO3;KOH、NH3.H2O;NaNO3;H2O;
(3)上述①③⑦⑧⑨中属于电解质的是①H2SO4③NaOH,⑦⑧⑨属于非电解质,是强电解质,Na2SO4
在水溶液中能完全电离出钠离子和硫酸根离子,即Na2SO4=2Na++SO42-,故答案为:①③;Na2SO4=2Na++SO42-;
(4)二氧化硫是酸性氧化物,可以和碱反应生成盐和水,⑦与足量③溶液反应的离子反应方程式为:SO2+2OH-═H2O+SO32-,故答案为:SO2+2OH-═H2O+SO32-.
点评 本题考查物质的分类、离子方程式的书写等知识,题目难度不大,注意把握相关概念是关键.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
4.下列所给溶液,溶质物质的量浓度为1mol•L-1的是( )
| A. | 含Na+为2mol的Na2SO4溶液 | |
| B. | 将1LHCl溶于1 L水 | |
| C. | 将1 L 0.8mol•L-1硫酸和 1L 1.2mol•L-1硫酸混合 | |
| D. | 将4.0gNaOH溶于水配成100mL溶液 |
1.下列反应中,不属于氧化还原反应的是( )
| A. | 3Cl2+6KOH═5KCl+KClO3+3H2O | B. | 2FeBr2+3Cl2═2FeCl3+2Br2 | ||
| C. | SnCl4+2H2O═SnO2+4HCl | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
8.下列有关物质用途的说法中,不正确的是( )
| A. | Fe2O3常用于制造红色油漆和涂料 | |
| B. | 明矾能够消毒杀菌是利用了胶体的吸附性 | |
| C. | 氧化铝可用来制造耐高温的实验仪器 | |
| D. | 二氧化硅可用于制造光导纤维 |
5.现有下列九种物质:
①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(每空一分):
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)将②加入NaOH的溶液中反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(每空一分):
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)将②加入NaOH的溶液中反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
2.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得
S2Cl2粗品.
②有关物质的部分性质如下表:
设计实验装置图如下:
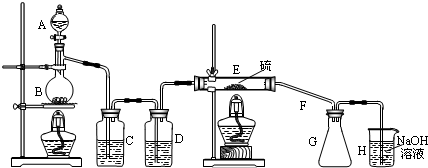
(1)E中反应的化学方程式2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
(2)C、D中的试剂分别是饱和食盐水、浓硫酸(填试剂名称).
(3)F的作用是导气、冷凝.
(4)如果在加热E时温度过高,对实验结果的影响是产率降低(或S2Cl2分解),在F中可能出现的现象是有黄色固体生成.
(5)S2Cl2粗品中可能混有的杂质是(填写两种)SCl2、Cl2或S,为了提高S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不要过快.
①将干燥的氯气在110℃~140℃与硫反应,即可得
S2Cl2粗品.
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl,SO2,S2,300℃以上万全分解: S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2SCl2 |

(1)E中反应的化学方程式2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
(2)C、D中的试剂分别是饱和食盐水、浓硫酸(填试剂名称).
(3)F的作用是导气、冷凝.
(4)如果在加热E时温度过高,对实验结果的影响是产率降低(或S2Cl2分解),在F中可能出现的现象是有黄色固体生成.
(5)S2Cl2粗品中可能混有的杂质是(填写两种)SCl2、Cl2或S,为了提高S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不要过快.