题目内容
14.已知外电路中,电子由铜流向a极.有关图中装置分析合理的一项是( )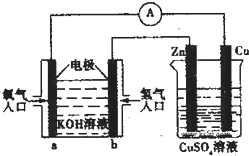
| A. | 一段时间后锌片质量减少 | |
| B. | 该装之中Cu极为正极 | |
| C. | b极的电极反应式:H2-2e-═2H+ | |
| D. | 当铜片的质量变化为12.8g时,a极上消耗的 O2在标况下的体积为2.24L |
分析 根据图知,左边装置在燃料电池,通入燃料氢气的电极b是负极、a是正极,电解质溶液呈碱性,则负极反应式为H2-2e-+2OH-=2H2O、正极反应式为O2+2H2O+4e-=4OH-;右边装置是电解池,Zn是阴极、Cu是阳极,相当于电镀池,阳极上电极反应式为Cu-2e-=Cu2+、阴极电极反应式为Cu2++2e-=Cu,据此分析解答.
解答 解:根据图知,左边装置在燃料电池,通入燃料氢气的电极b是负极、a是正极,电解质溶液呈碱性,则负极反应式为H2-2e-+2OH-=2H2O、正极反应式为O2+2H2O+4e-=4OH-;右边装置是电解池,Zn是阴极、Cu是阳极,相当于电镀池,阳极上电极反应式为Cu-2e-=Cu2+、阴极电极反应式为Cu2++2e-=Cu,
A.锌作阴极被保护,锌电极上铜离子得电子生成Cu,所以锌片质量增加,故A错误;
B.通过以上分析知,Cu是阳极,故B错误;
C.电解质溶液呈碱性,所以b电极反应式为H2-2e-+2OH-=2H2O,故C错误;
D.当铜电极消耗12.8g时,n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,转移电子物质的量=0.2mol×2=0.4mol,根据转移电子守恒得消耗氧气体积=$\frac{0.4mol}{4}$=2.24L,故D正确;
故选D.
点评 本题考查原电池和电解池原理,为高频考点,明确原电池和电解池判断方法及各个电极上发生的反应是解本题关键,难点是电极反应式的书写,易错选项是C,注意碱性条件下不能生成氢离子.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
2.下列实验操作正确或能达到目的是( )
| A. | 托盘上各放一张滤纸,然后在右盘上添加2g砝码,称取2.0gNaOH固体 | |
| B. | 保存FeSO4溶液时,可以加入铁钉或铁粉来防止Fe2+被氧化 | |
| C. | 向沸水中边滴加FeCl3溶液边用玻璃棒搅拌,可制得Fe(OH)3胶体 | |
| D. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
9.aL某浓度的SnC12溶液与过量FeC13溶液充分混合后,再加入$\frac{a}{2}$L 0.2000mol•L-1 K2Cr2O7溶液,恰好完全反应,则SnC12的浓度为(提示:①2Fe3++Sn2+═2Fe2++Sn4+;②6Fe2++Cr2O${\;}_{7}^{2-}$+14H+═6Fe3++2Cr3++7H2O)( )
| A. | 0.3000mol•L-1 | B. | 1.2000 mol•L-1 | C. | 0.0333mol•L-1 | D. | 0.1333 mol•L-1 |
3.下列离子或分子在指定介质中能大量共存的是( )
| A. | 硝酸亚铁溶液中:Al3+、H+、SO42-、Cl-、CO32- | |
| B. | 透明溶液中:Cu2+、Fe3+、NH4+、NO3-、SO42- | |
| C. | 强酸性溶液中:CH3CH2OH、Mg2+、MnO4-、SiO32- | |
| D. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- |
4.下列所给溶液,溶质物质的量浓度为1mol•L-1的是( )
| A. | 含Na+为2mol的Na2SO4溶液 | |
| B. | 将1LHCl溶于1 L水 | |
| C. | 将1 L 0.8mol•L-1硫酸和 1L 1.2mol•L-1硫酸混合 | |
| D. | 将4.0gNaOH溶于水配成100mL溶液 |
 A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题.
A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题.