题目内容
20.中草药秦皮中含有的七叶树内酯结构是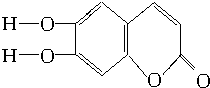 (C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
(C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )| A. | 3 mol Br2、2 mol NaOH | B. | 3 mol Br2、4 mol NaOH | ||
| C. | 2 mol Br2、3 mol NaOH | D. | 4 mol Br2、4 mol NaOH |
分析 该物质中含有酯基、酚羟基、苯环、碳碳双键,具有酚、酯和苯的性质,能发生显色反应、氧化反应、取代反应、水解反应及加成反应,酚羟基苯环上邻对位H原子能被溴原子取代,酯基能和NaOH水溶液发生水解反应,酚羟基和NaOH发生中和反应,据此分析解答.
解答 解:酚羟基苯环上邻对位H原子能被溴原子取代,酯基能和NaOH水溶液发生水解反应,酚羟基和NaOH发生中和反应,碳碳双键和溴发生加成反应,1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,酯基水解生成的酚羟基和羧基都能和NaOH反应,消耗溴的物质的量为3mol、NaOH的物质的量为4mol,故选B.
点评 本题考查有机物结构和性质,为高考高频点,明确物质官能团及其性质是解本题关键,注意酯基水解生成的酚羟基能和NaOH发生中和反应,题目难度不大.

练习册系列答案
相关题目
10.下列叙述正确的是( )
| A. | 用铂丝蘸取碳酸钾溶液,在火焰上灼烧时呈紫色 | |
| B. | 透过蓝色钴玻璃观察火焰呈紫色,说明该溶液中只含K+ | |
| C. | 现代化学分析测试中常用到元素分析仪、红外光谱仪、原子吸收光谱等 | |
| D. | 焰色反应是化学变化 |
11.已知工业上真空炼铷的原理如下:2RbCl+Mg?MgCl2+2Rb(g),对于此反应的进行能给予正确解释的是( )
| A. | 铷的金属活动性不如镁强,故镁可置换铷 | |
| B. | 铷的沸点比镁低,把铷蒸气抽出时,平衡右移 | |
| C. | MgCl2的热稳定性不如Rb强 | |
| D. | 铷的单质状态较化合态更稳定 |
8.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n.下列说法不正确的是( )
| A. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X | |
| B. | 若8>m>3,则X必定为主族元素 | |
| C. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子 | |
| D. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y |
15.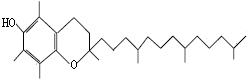 蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
 蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )| A. | 维生素E的化学式为:C29H50O2 | |
| B. | 维生素E的还原性主要是酚羟基表现出来,若被酯化后就不具有抗氧化活性 | |
| C. | 维生素E易溶于水和乙醇、苯等有机溶剂 | |
| D. | 维生素E虽含有酚羟基,但不能与溴水反应 |
12.化学反应C(s)+H2O(g)?CO(g)+H2(g)(正反应为吸热反应)达到平衡,下列叙述中正确的是( )
| A. | 扩大容器的容积,平衡向正反应方向移动 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 加入水蒸气使容器压强增大,平衡向逆反应方向移动 | |
| D. | 加入固体碳,平衡向正反应方向移动 |
9.下列反应中,水作为还原剂的是( )
| A. | Cl2+H2O=HCl+HClO | B. | 2Na2O2+2H2O=4NaOH+O2? | ||
| C. | 2F2+2H2O=4HF+O2? | D. | 2Na+4H2O=2NaOH+H2? |
10.原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据:
请回答下列问题:
(1)B、C、D三种元素第一电离能数值由小到大的顺序是S<P<Cl(填元素符号);
(2)B的氢化物中心原子采取sp3杂化,空间构型是三角锥形,是极性分子(填“极性”或“非极性”);
(3)F2+与NH3形成配离子的化学式为[Cu(NH3)4]2+,F单质晶体晶胞是下图的③(填①、②、③或④);
(4)A,E两种元素形成晶体晶胞是图中的②(填①、②、③或④),A离子的配位数是4;若晶胞边长为apm(皮米),则A,E两种粒子的最近距离可表示为$\frac{\sqrt{3}}{4}$apm
(5)图5四条折线分别表示Ⅳ族、VA族、ⅥA族、VⅡA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线n(填n,m,x或y)

| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是S<P<Cl(填元素符号);
(2)B的氢化物中心原子采取sp3杂化,空间构型是三角锥形,是极性分子(填“极性”或“非极性”);
(3)F2+与NH3形成配离子的化学式为[Cu(NH3)4]2+,F单质晶体晶胞是下图的③(填①、②、③或④);
(4)A,E两种元素形成晶体晶胞是图中的②(填①、②、③或④),A离子的配位数是4;若晶胞边长为apm(皮米),则A,E两种粒子的最近距离可表示为$\frac{\sqrt{3}}{4}$apm
(5)图5四条折线分别表示Ⅳ族、VA族、ⅥA族、VⅡA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线n(填n,m,x或y)
