题目内容
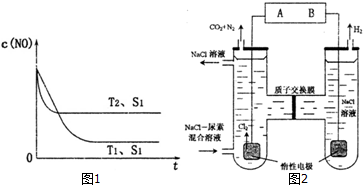
12.化学反应C(s)+H2O(g)?CO(g)+H2(g)(正反应为吸热反应)达到平衡,下列叙述中正确的是( )| A. | 扩大容器的容积,平衡向正反应方向移动 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 加入水蒸气使容器压强增大,平衡向逆反应方向移动 | |
| D. | 加入固体碳,平衡向正反应方向移动 |
分析 A、扩大容器的容积,减小压强,化学平衡向着气体体积增大的方向进行;
B、升高温度,所有化学反应速率都会加快;
C、增加反应物的浓度是使得化学平衡正向移动;
D、固体量的增减不会引起化学平衡的移动.
解答 解:A、扩大容器的容积,减小压强,化学平衡向着气体体积增大的方向即正方向移动,故A正确;
B、升高温度,所有化学反应的正逆反应速率都会加快,故B错误;
C、增加反应物水的浓度会使得化学平衡正向移动,故C错误;
D、固体C的量的增减不会引起化学平衡的移动,故D错误;
故选A.
点评 化学平衡的移动受到温度、浓度、压强等因素的影响,注意固体量的增减不会引起化学平衡的移动这一点是关键,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
3.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强);简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)请你预测Br与I元素的X数值的大小关系Br大于I.
(4)某化合物分子中含有S-N键,你认为该共享电子对偏向于N原子(填元素符号).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强);简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)请你预测Br与I元素的X数值的大小关系Br大于I.
(4)某化合物分子中含有S-N键,你认为该共享电子对偏向于N原子(填元素符号).
20.中草药秦皮中含有的七叶树内酯结构是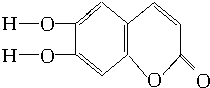 (C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
(C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
 (C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
(C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )| A. | 3 mol Br2、2 mol NaOH | B. | 3 mol Br2、4 mol NaOH | ||
| C. | 2 mol Br2、3 mol NaOH | D. | 4 mol Br2、4 mol NaOH |
7.人造象牙主要成分的结构是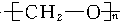 ,它是通过加聚反应制得的,则合成象牙的单体是( )
,它是通过加聚反应制得的,则合成象牙的单体是( )
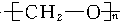 ,它是通过加聚反应制得的,则合成象牙的单体是( )
,它是通过加聚反应制得的,则合成象牙的单体是( )| A. | (CH3)2O | B. | CH3CHO | C. | HCHO | D. | C2H2和H2O |
1.将Na2O2逐渐加入到含有Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、NH4+的物质的量分别是( )
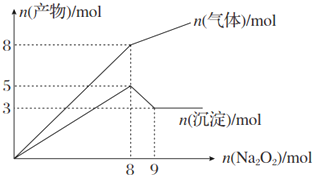

| A. | 2 mol、3 mol、4 mol | B. | 2 mol、3 mol、8 mol | ||
| C. | 3 mol、2 mol、8 mol | D. | 3 mol、2 mol、4 mol |
2.把7.4g Na2CO3•10H2O 和 NaHCO3组成的混合物溶于水配成100mL溶液,其中c(Na+)=0.6mol/L.若把等质量的混合物加热至恒重,残留物的质量是( )
| A. | 3.18g | B. | 2.12g | C. | 4.22g | D. | 5.28g |