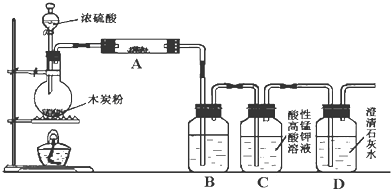
题目内容
5.写出下列反应的方程式,并注明反应类型.(1)以CH3CHClCH3和必要的无机试剂为原料,制取CH3CHOHCH2OH(1,2-丙二醇).
(2)由碘乙烷合成溴乙烷.
分析 (1)CH3CHClCH3为主要原料制取1,2-丙二醇CH3CH(OH)CH2OH,-Cl变化为两个-OH,应先消去生成C=C,再加成引入两个卤素原子,最后水解即可,以此来解答;
(2)由碘乙烷合成溴乙烷,-I变化成-Br,应先消去生成C=C,再加成引入1个Br原子,以此来解答.
解答 解:(1)CH3CHClCH3为主要原料制取1,2-丙二醇CH3CH(OH)CH2OH,
①先发生氯代烃的消去反应生成C=C,方程式为:CH3CHClCH3+NaOH$→_{△}^{乙醇}$CH2═CHCH3+NaCl+H2O,消去反应;
②再发生丙烯的加成反应引入两个卤素原子,方程式为:CH2═CHCH3+Cl2→CH2ClCHClCH3,加成反应;
③最后发生卤代烃的水解反应(属于取代反应)生成CH3CH(OH)CH2OH,方程式为:CH2ClCHClCH3+2H2O$→_{△}^{NaOH}$CH2OHCHOHCH3+2HCl,取代反应.
故答案为:CH3CHClCH3+NaOH$→_{△}^{乙醇}$CH2═CHCH3+NaCl+H2O,消去反应;CH2═CHCH3+Cl2→CH2ClCHClCH3,加成反应;CH2ClCHClCH3+2H2O$→_{△}^{NaOH}$CH2OHCHOHCH3+2HCl,取代反应.
(2)由碘乙烷合成溴乙烷,-I变化成-Br,
①应先消去生成C=C,方程式为:CH3CH2I+NaOH$→_{△}^{乙醇}$CH2=CH2+NaI+H2O,消去反应;
②再加成引入1个Br原子,方程式为:CH2═CH2+HBr$\stackrel{催化剂}{→}$CH3CH2Br,加成反应.
故答案为:CH3CH2I+NaOH$→_{△}^{乙醇}$CH2=CH2+NaI+H2O,消去反应;CH2═CH2+HBr$\stackrel{催化剂}{→}$CH3CH2Br,加成反应.
点评 本题考查有机物的合成,注意官能团的变化,结合卤代烃、烯烃的性质即可解答,题目难度不大.

| A. | 一定是同种元素 | B. | 一定是一种分子和一种离子 | ||
| C. | 一定是不同离子 | D. | 无法判断 |
| A. | Al | B. | Ag | C. | Fe | D. | Pt |
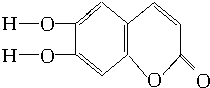 (C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
(C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )| A. | 3 mol Br2、2 mol NaOH | B. | 3 mol Br2、4 mol NaOH | ||
| C. | 2 mol Br2、3 mol NaOH | D. | 4 mol Br2、4 mol NaOH |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大 |
| A. | 明矾能水解生成氢氧化铝胶体,可用作净水剂 | |
| B. | 石英、玛瑙、水晶通常作为装饰品使用,但都可溶于氢氟酸 | |
| C. | Na2CO3俗称纯碱,可与盐酸反应,故可用于治疗人体内胃酸过多 | |
| D. | 农村施肥时,草木灰不能与铵态氮肥混用,以免氮肥肥效下降 |
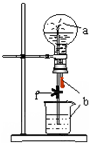 如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是 | a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 饱和NaHCO3溶液 |
| C | Cl2 | 饱和NaCl水溶液 |
| D | NH3 | NaNO3稀溶液 |
| A. | A | B. | B | C. | C | D. | D |