题目内容
9.下列反应中,水作为还原剂的是( )| A. | Cl2+H2O=HCl+HClO | B. | 2Na2O2+2H2O=4NaOH+O2? | ||
| C. | 2F2+2H2O=4HF+O2? | D. | 2Na+4H2O=2NaOH+H2? |
分析 水作还原剂,则水中O元素的化合价升高,以此来解答.
解答 解:A.只有Cl元素的化合价变化,水不是氧化剂,也不是还原剂,故A不选;
B.只有过氧化钠中O元素的化合价变化,水不是氧化剂,也不是还原剂,故B不选;
C.水中O元素的化合价升高,则水为还原剂,故C选;
D.水中H元素的化合价降低,则水为氧化剂,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重还原剂判断的考查,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
19.一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)△H=+148.9kJ•mol-1
(1)下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示.
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:t1时反应已经达到化学平衡状态.
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应ade(填序号).
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大.
(1)下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示.
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应ade(填序号).
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大.
20.中草药秦皮中含有的七叶树内酯结构是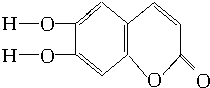 (C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
(C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
 (C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
(C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )| A. | 3 mol Br2、2 mol NaOH | B. | 3 mol Br2、4 mol NaOH | ||
| C. | 2 mol Br2、3 mol NaOH | D. | 4 mol Br2、4 mol NaOH |
14.化学于生产、生活,并应用于生产、生活,下列有关说法不正确的是( )
| A. | 明矾能水解生成氢氧化铝胶体,可用作净水剂 | |
| B. | 石英、玛瑙、水晶通常作为装饰品使用,但都可溶于氢氟酸 | |
| C. | Na2CO3俗称纯碱,可与盐酸反应,故可用于治疗人体内胃酸过多 | |
| D. | 农村施肥时,草木灰不能与铵态氮肥混用,以免氮肥肥效下降 |
1.将Na2O2逐渐加入到含有Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、NH4+的物质的量分别是( )
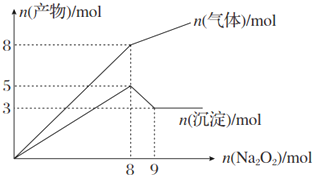

| A. | 2 mol、3 mol、4 mol | B. | 2 mol、3 mol、8 mol | ||
| C. | 3 mol、2 mol、8 mol | D. | 3 mol、2 mol、4 mol |
6.实验室里需用道480mL0.1mol/L的硫酸铜溶液,以下配制溶液的操作正确的是( )
| A. | 称取7.6g硫酸铜,加入500 mL的水 | B. | 称取8.0g硫酸铜,配成500mL溶液 | ||
| C. | 称取12.0g胆矾,配成500mL溶液 | D. | 称取12.5g胆矾,加入500mL水 |
 .
.