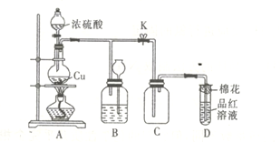
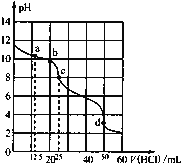
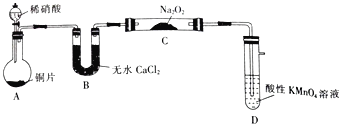
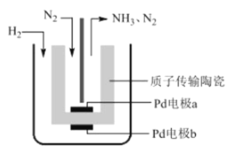
题目内容
【题目】氯的原子序数为17,35Cl是氯元素的一种核素,下列说法正确的是
A.35Cl原子所含质子数为18B.![]() mol的1H35Cl分子所含中子数约为6.02×1023
mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 LD.35Cl2气体的摩尔质量为71 g / mol
【答案】B
【解析】
A. 35Cl是氯元素的一种核素,氯元素的质子数为17,故A错误;
B. 35Cl所含中子数=35-17=18,1H不含中子,所以一个1H35Cl分子所含中子数为18NA,![]() mol的1H35Cl分子所含中子数为1NA,即6.02×1023,故B正确;
mol的1H35Cl分子所含中子数为1NA,即6.02×1023,故B正确;
C. 未指明温度和压强,无法确定气体的体积,故C错误;
D. 35Cl的相对原子质量为35,所以35Cl2的相对分子质量为70,所以35Cl2气体的摩尔质量为70 g / mol,故D错误;
故答案为B。

练习册系列答案
相关题目