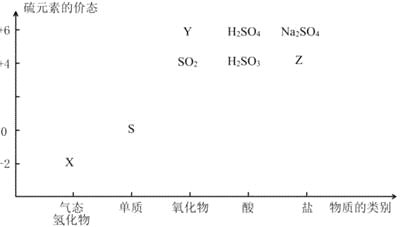
题目内容
【题目】在常温下,0.1000mol/L Na2CO3溶液25mL用0.1000mol/L盐酸滴定,滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是
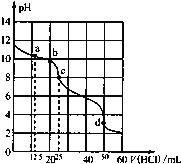
A.a点:c(CO32-)>c(HCO3﹣)>c(OH﹣)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3﹣)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
【答案】BD
【解析】
A.a点时n(HCl)=0.1 mol/L×0.0125 L=0.00125 mol,反应生成0.00125 mol NaHCO3,剩余0.00125 mol Na2CO3,由于CO32-的水解程度大于HCO3-的电离程度,则c(HCO3﹣)>c(CO32-),A错误;
B.b点时n(HCl)=0.1 mol/L×0.02 L=0.002 mol,由物料守恒可知5c(Cl﹣)=4c(HCO3﹣)+4c(CO32﹣)+4c(H2CO3),则5c(Cl﹣)>4c(HCO3﹣)+4c(CO32﹣),B正确;
C.c点时n(HCl)=0.1 mol/L×0.025 L=0.0025 mol,恰好完全反应生成NaHCO3,根据质子守恒可:c(OH-)=c(H+)+c(H2CO3)-c(CO32-),C错误;
D.d点时加入盐酸0.005 mol,溶液中溶质恰好反应产生NaCl、H2O、CO2,溶液存在电荷守恒,存在c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH﹣)+c(Cl-),由于c(Na+)=c(Cl-),则 c(H+)=c(HCO3-)+2c(CO32-)+c(OH﹣),D正确;
答案选BD。

【题目】2019年是元素周期表诞生150周年,元素周期表在学习、研究和生产实践中有很重要的作用。①~⑥六种元素在元素周期表中的位置如下:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ |
请回答下列问题:
(1)⑥的元素符号为___________。
(2)由①③④形成的化合物是一种强碱,其化学式____________。
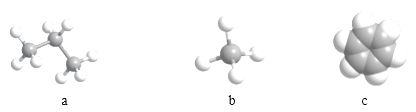
(3)由①②形成的最简单化合物的分子模型为_____________(填序号)
(4)⑤和⑥两种元素的最高价氧化物对应的水化物之间反应的离子方程式为________________________________。