题目内容
【题目】我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18O49纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
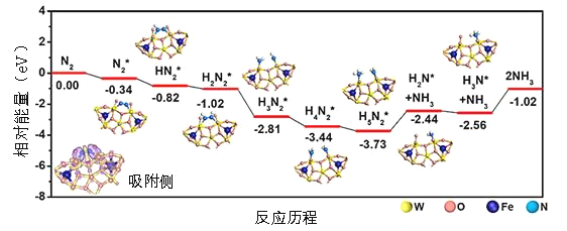
(1)需要吸收能量最大的能垒(活化能)E=__ev,该步骤的化学方程式为___;
(2)对于合成氨反应N2+3H2![]() 2NH3,在标况下,平衡常数Kθ=
2NH3,在标况下,平衡常数Kθ=![]() ,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
①若起始N2和H2物质的量之比为1:3,反应在恒定温度和标准压强下进行,达到平衡时H2的转化率为ɑ,则Kθ=___(用含ɑ的最简式表示)。
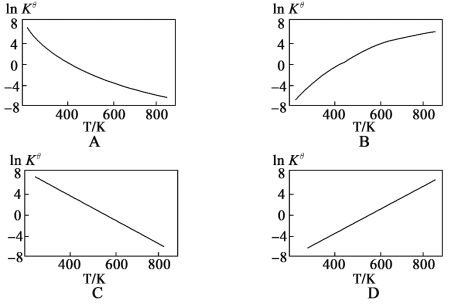
②图中可以示意标准平衡常数Kθ随温度T变化趋势的是___(填序号).
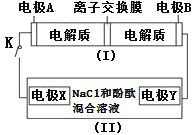
(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。
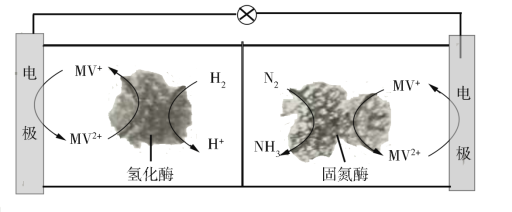
该电池工作时,正极的电极反应为___。中间所用的交换膜应该为___(填“阳离子交换膜”或“阴离子交换膜”或“质子交换膜”)。相比现有工业合成氨,该方法的优点是:___。(任写一条)
【答案】1.54 NH3*+NH3=2NH3 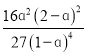 A MV2++e-=MV+ 质子交换膜 条件温和、生成氨的同时释放电能
A MV2++e-=MV+ 质子交换膜 条件温和、生成氨的同时释放电能
【解析】
(1)吸收能量最大的能垒,即相对能量的差最大;根据图示写方程式;
(2)①若1mol N2和3mol H2完全反应,则理论上生成2molNH3,NH3的平衡产率为ɑ,则生成的NH3为2ɑmol,通过三段式计算有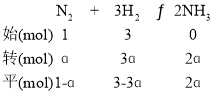 ,平衡时混合气体的物质的量=1-ɑ +3-3ɑ+2ɑ=4-2ɑmol,此时p(NH3)=
,平衡时混合气体的物质的量=1-ɑ +3-3ɑ+2ɑ=4-2ɑmol,此时p(NH3)=![]() pθ,p(N2)=
pθ,p(N2)= ![]() pθ,p(H2)=
pθ,p(H2)= ![]() pθ,根据Kθ=
pθ,根据Kθ=![]() 计算;
计算;
②升高温度,平衡逆向移动,Kθ减小;
(3)生物燃料电池的工作原理是N2+3H2![]() 2NH3,其中N2在正极区得电子发生还原反应,H2在负极区失电子发生氧化反应,原电池工作时阳离子向正极区移动,据此分析判断。
2NH3,其中N2在正极区得电子发生还原反应,H2在负极区失电子发生氧化反应,原电池工作时阳离子向正极区移动,据此分析判断。
(1)根据图示,吸收能量最大的能垒,即相对能量的差最大是-1.02-(-2.56)=1.54;根据图示,该步的方程式是NH3*+NH3=2NH3,故答案为:1.54;NH3*+NH3=2NH3;
(2) ①若1mol N2和3mol H2完全反应,则理论上生成2molNH3,NH3的平衡产率为ɑ,则生成的NH3为2ɑmol,通过三段式计算有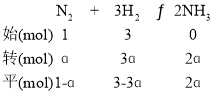 ,平衡时混合气体的物质的量=1-ɑ +3-3ɑ+2ɑ=4-2ɑmol,此时p(NH3)=
,平衡时混合气体的物质的量=1-ɑ +3-3ɑ+2ɑ=4-2ɑmol,此时p(NH3)=![]() pθ,p(N2)=
pθ,p(N2)= ![]() pθ,p(H2)=
pθ,p(H2)= ![]() pθ,根据Kθ=
pθ,根据Kθ=![]() =
=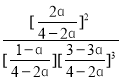 =
=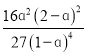 ,故答案为:
,故答案为: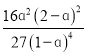 ;
;
②升高温度,平衡逆向移动,Kθ减小,ln Kθ减小,因此变化趋势的图为A,故答案为:A;
(3)正极区发生还原反应,电极上的反应为:MV2++e-=MV+;右室氮气得电子,为正极区,氮气在固氮酶催化作用下发生反应N2+6MV++6H+=2NH3+6MV2+,阳离子由负极移向正极,所以电池工作时,氢离子通过交换膜由负极区向正极区移动,交换膜应该为质子交换膜;传统工业合成氨反应条件为高温、高压、催化剂,反应条件苛刻,该方法制取氨气条件温和、生成氨的同时释放电能,故答案为:MV2++e-=MV+;质子交换膜;条件温和、生成氨的同时释放电能。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。