题目内容
【题目】一种电解法合成氨的装置如图所示,该法采用高质子导电性的 SCY 陶瓷,用吸附在它内外表面上的金属 Pd 多晶薄膜做电极,实现了 570℃、常压下高转化率合成氨。下列叙述正确的是
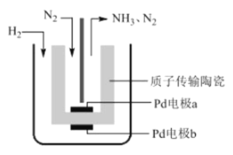
A.阴极的电极反应式为 N2 +8H+ +6e-=2NH4+
B.该装置工作时,H+ 从 a 极区向 b 极区迁移
C.每生成 1mol NH3 ,有 3g H2 被氧化
D.该装置实现了在常温常压下高转化率合成氨
【答案】C
【解析】
反应总方程式为N2+3H22NH3,反应中N元素化合价降低,被还原,a应为电解池阴极,电极电极式为N2+6e-+6H+═2NH3,H元素化合价升高,被氧化,b应为电解池阳极反应,电极反应式为H2-2e-=2H+,以此解答该题。
A.a为阴极,发生还原反应,电极方程式为N2+6e+6H+═2NH3,故A错误;
B.a为阴极,b为阳极,阳极连接电源正极,氢离子移向阴极,从b极区向a极区迁移,故B错误;
C.根据电解反应和电子守恒得到N2+6e+6H+═2NH3,H22e=2H+,2NH36e3H2,每生成1molNH3,有1.5mol氢气参与电极反应,即有3gH2被氧化,故C正确;
D.采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨,故D错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】2019年是元素周期表诞生150周年,元素周期表在学习、研究和生产实践中有很重要的作用。①~⑥六种元素在元素周期表中的位置如下:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ |
请回答下列问题:
(1)⑥的元素符号为___________。
(2)由①③④形成的化合物是一种强碱,其化学式____________。
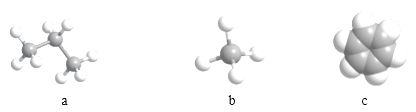
(3)由①②形成的最简单化合物的分子模型为_____________(填序号)
(4)⑤和⑥两种元素的最高价氧化物对应的水化物之间反应的离子方程式为________________________________。
【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
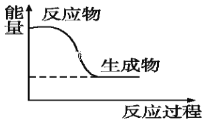
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。