题目内容
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:
(实验一)制取NaNO2
该小组先查阅资料知:①2NO+Na2O2→2NaNO2;2NO2+Na2O2→2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如图(夹持装置略去):
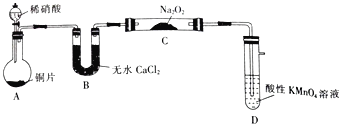
(1)装置D的作用是_______________;如果没有B装置,C中发生的副反应有_______________。
(2)就算在装置气密性良好的情况下进行实验,该小组发现制得的NaNO2的纯度也不高,可能的原因是由_____________;设计一种提高NaNO2纯度的改进措施_________。
(实验二)测定NaNO2样品(含NaNO3杂质)的纯度
先查阅资料知:①5NO2-+2MnO4-+6H+→5NO3-+3Mn2++3H2O;
②MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
然后,设计如下方案测定样品的纯度:
样品→溶液A ![]() 溶液B
溶液B ![]() 数据处理
数据处理
(3)取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol/L的酸性高锰酸钾溶液在锥形瓶中充分反应.反应后的溶液用0.1000 mol/L (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为_________.
(4)通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是_________。(填字母编号)
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
【答案】吸收多余的NO 2Na2O2+2H2O=4NaOH+O2↑、2NO+O2=NO2 由于获得NO的过程中会产生其他氮氧化物 在A、B之间增加装有水的洗气瓶 75% bc
【解析】
在装置A中稀硝酸与Cu反应产生Cu(NO3)2、NO和H2O,反应产生的NO气体经B装置的无水CaCl2干燥后进入装置C中,发生反应:2NO+Na2O2=2NaNO2,未反应的NO在装置D中被酸性KMnO4氧化除去。再用酸性KMnO4溶液测定NaNO2纯度中,可根据反应过程中的电子得失数目相等计算,利用反应过程中操作使KMnO4溶液消耗体积大小上分析实验误差。
(1)酸性KMnO4溶液具有氧化性,能将NO氧化为NO3-,所以装置D的作用是吸收多余的NO;若没有装置B中无水CaCl2的干燥作用,其中的H2O就会与Na2O2发生反应:2Na2O2+2H2O=4NaOH+O2↑,反应产生O2再与NO反应:2NO+O2=NO2,气体变为NO2;
(2)由于反应开始时硝酸浓度较大时,可能有NO2产生,获得NO的过程中可能会产生其他氮氧化物,这样会干扰实验结果,提高NaNO2纯度可以在A、B之间增加装有水的洗气瓶,减小实验误差;
(3)根据电子守恒可得关系式:5(NH4)2Fe(SO4)2~MnO4-,消耗n(KMnO4)=0.1 mol/L×0.01 L=0.001 mol,根据2MnO4-~5NO2-可知NO2-反应消耗KMnO4溶液的物质的量n(KMnO4)=0.05 mol/L×0.024 L-0.001mol=2.0×10-4 mol,则NaNO2的物质的量n(NaNO2)= 5.0×10-4 mol,则100 mL溶液中含NaNO2的物质的量为n(NaNO2)总=5.0×10-4 mol×![]() =5.0×10-3 mol,所以样品中NaNO2的纯度为
=5.0×10-3 mol,所以样品中NaNO2的纯度为![]() ×100%=75%;
×100%=75%;
(4)a.滴定至溶液紫色刚刚好褪去,消耗(NH4)2Fe(SO4)2标准溶液体积偏小,n[(NH4)2Fe(SO4)2]偏小,导致NaNO2的量测定结果偏高,a正确;
b.加入A与KMnO4溶液前锥形瓶未经干燥,对测量结果无影响,b错误;
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中时间过长,部分(NH4)2Fe(SO4)2被氧化,消耗的(NH4)2Fe(SO4)2偏大,导致的测量结果偏低,c错误;
故合理选项是bc。

 阅读快车系列答案
阅读快车系列答案


