题目内容
10.几种常见物质之间的转化关系如图所示,已知反应Ⅰ是重要的化学反应,X的相对分子质量为100,Z是温室气体,Q是日常生活中常见的塑料,不能作食品的包装材料.请回答下列问题:
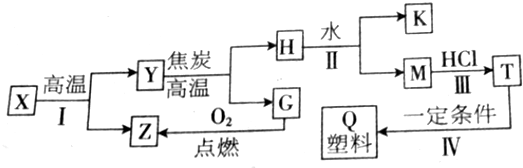
(1)X的化学式为CaCO3,H的名称是碳化钙;
(2)写出反应Ⅲ的反应类型:加成反应;
(3)写出反应Ⅳ的化学方程式:nCH2=CHCl$\stackrel{催化剂}{→}$

(4)将T通入溴的四氯化碳溶液中,现象可能是溴的四氯化碳溶液褪色.写出反应的化学方程式:CH2=CHCl+Br2→CH2BrCHBrCl.
分析 X的相对分子质量为100,Z是温室气体,X高温分解得Y和Z,所以X为CaCO3,Y为CaO,Z为CO2,根据题中各物质转化关系及条件可知,CaO与C在高温条件下反应生成H为CaC2,与水生成K和M,M与氯化氢反应得T,T在一定条件下反应生成Q,Q是日常生活中常见的塑料,不能作食品的包装材料,所以Q为 ,据此可以反推得K为Ca(OH)2,M为C2H2,T为CH2=CHCl,据此答题.
,据此可以反推得K为Ca(OH)2,M为C2H2,T为CH2=CHCl,据此答题.
解答 解:X的相对分子质量为100,Z是温室气体,X高温分解得Y和Z,所以X为CaCO3,Y为CaO,Z为CO2,根据题中各物质转化关系及条件可知,CaO与C在高温条件下反应生成H为CaC2,与水生成K和M,M与氯化氢反应得T,T在一定条件下反应生成Q,Q是日常生活中常见的塑料,不能作食品的包装材料,所以Q为 ,据此可以反推得K为Ca(OH)2,M为C2H2,T为CH2=CHCl,
,据此可以反推得K为Ca(OH)2,M为C2H2,T为CH2=CHCl,
(1)根据上面的分析可知在,X为CaCO3,H为CaC2,H的名称是碳化钙,
故答案为:CaCO3;碳化钙;
(2)反应Ⅲ为乙炔与氯化氢发生加成反应生成氯乙烯,所以反应类型为加成反应,
故答案为:加成反应;
(3)反应Ⅳ的化学方程式为nCH2=CHCl$\stackrel{催化剂}{→}$ ,
,
故答案为:nCH2=CHCl$\stackrel{催化剂}{→}$ ;
;
(4)T为CH2=CHCl,将T通入溴的四氯化碳溶液中,由于中有碳碳双键,可以与溴发生加成反应,所以反应的现象是溴的四氯化碳溶液褪色,反应的化学方程式为CH2=CHCl+Br2→CH2BrCHBrCl,
故答案为:溴的四氯化碳溶液褪色;CH2=CHCl+Br2→CH2BrCHBrCl.
点评 本题考查了物质的推断与性质,抓住常见物质的相对分子质量和用途是解答的关键,题目难度中等,答题时注意化学用语的规范表达.

 优等生题库系列答案
优等生题库系列答案| A. | 某单质在常温下跟水反应不如钠剧烈 | |
| B. | 某碳酸盐易溶于水 | |
| C. | 其原子半径比钾原子半径小 | |
| D. | 某氢氧化物不能使Al(OH)3溶解 |

已知:
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在圆底烧瓶中加入4.0g苯甲酸,10mL 95%的乙醇(过量),8mL环己烷以及3mL浓硫酸,混合均匀并加入沸石,按图所示装好仪器,控制温度在65~70℃加热回流2h.利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
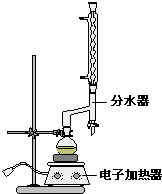
②反应一段时间,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性.用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分.
④检验合格,测得产品体积为2.3mL.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①加入沸石的作用是防止暴沸.如果加热一段时间后发现忘记加沸石,应该采取的正确操作是:冷却后补加
(3)步骤①中使用分水器不断分离除去水的目的是使平衡不断地向正向移动
(4)步骤③加入Na2CO3加入不足,在之后蒸馏时蒸馏烧瓶中可见到白烟生成,产生该现象的原因在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华;
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器.使用分液漏斗前必须检查是否漏水
(6)计算本实验的产率为49.1%.
(1)写出该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$; K( 200℃)> K( 300℃)(填“>”、“=”或“<”).
(2)在773K时,一氧化碳变换反应的平衡常数K=9,如反应开始时CO和H2O的浓度都是0.020•mol-l,则在此反应条件下一氧化碳的转化率为75%.
(3)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO30%、CO210%(均为体积分数).现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,以除去其中的CO.已知不同温度及反应物投料比($\frac{n{H}_{2}O}{n(CO)}$ )下,变换后平衡混合气体中CO的体积分数如下表所示:
| 投料比 CO体积分数/% 温度/℃ | $\frac{n{H}_{2}O}{n(CO)}$=1 | $\frac{n{H}_{2}O}{n(CO)}$=3 | $\frac{n{H}_{2}O}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
③温度为300℃、$\frac{n{H}_{2}O}{n(CO)}$=1时,变换后的平衡混合气体中CO2的体积分数是24.8%.(结果保留3位有效数字).
| A. | 某原子K层上只有一个电子 | |
| B. | 某原子M层上电子数为L层电子数的4倍 | |
| C. | 某离子M层上的电子数为K层的4倍 | |
| D. | 阴离子的最外层电子数可能为2,也可能为8 |

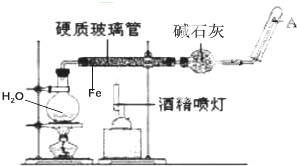 如图是在高温下,Fe与水蒸气的反应实验.
如图是在高温下,Fe与水蒸气的反应实验.