题目内容
6.工业上由焦炭或夭然气制氢气的过程中会产生一氧化碳.为了除去氢气中混有的一氧化碳,可在催化剂存在的条件下将一氧化碳与水蒸气发生反应:CO(g)+H2O( g)?CO2(g)+H2(g)△H=-41.0kJ•mol-l.该反应在工业上被称为“一氧化碳变换”.(1)写出该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$; K( 200℃)> K( 300℃)(填“>”、“=”或“<”).
(2)在773K时,一氧化碳变换反应的平衡常数K=9,如反应开始时CO和H2O的浓度都是0.020•mol-l,则在此反应条件下一氧化碳的转化率为75%.
(3)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO30%、CO210%(均为体积分数).现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,以除去其中的CO.已知不同温度及反应物投料比($\frac{n{H}_{2}O}{n(CO)}$ )下,变换后平衡混合气体中CO的体积分数如下表所示:
| 投料比 CO体积分数/% 温度/℃ | $\frac{n{H}_{2}O}{n(CO)}$=1 | $\frac{n{H}_{2}O}{n(CO)}$=3 | $\frac{n{H}_{2}O}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
③温度为300℃、$\frac{n{H}_{2}O}{n(CO)}$=1时,变换后的平衡混合气体中CO2的体积分数是24.8%.(结果保留3位有效数字).
分析 (1)化学平衡常数,是指在一定温度下,可逆反应到达平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体、纯液体不需要写出;
正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小;
(2)设平衡时CO的浓度变化量为xmol/L,利用三段式解题法表示出平衡时各组分浓度,代入平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$中计算x的值,进而计算CO转化率;
(3)①利用控制变量法,根据表中数据判断温度、反应物投料比对CO的体积分数的影响解答;
②从反应速率、平衡移动等进行分析解答;
③反应CO(g)+H2O(g)?CO2(g)+H2(g)中,反应前后气体的体积不变,则反应过程中气体的总体积不变,设反应原料气的总体积为V,计算出反应前CO、二氧化碳的体积;$\frac{n{H}_{2}O}{n(CO)}$=1,则加入水蒸气的体积与CO的体积相等,从而得出反应达到平衡时总体积;然后根据反应方程式、达到平衡时CO的体积分数计算出反应生成二氧化碳的体积,再计算出二氧化碳的体积分数.
解答 解:(1)反应CO(g)+H2O( g)?CO2(g)+H2(g)的平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$;
正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,K(200℃)>K(300℃),
故答案为:K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$;>;
(2)设平衡时CO的浓度变化量为xmol/L,则:
CO(g)+H2O( g)?CO2(g)+H2(g)
开始(mol/L):0.02 0.02 0 0
转化(mol/L):x x x x
平衡(mol/L):0.02-x 0.02-x x x x
则$\frac{x×x}{(0.02-x)×(0.02-x)}$=9,解得x=0.015
故CO的转化率为$\frac{0.015mol/L}{0.02mol/L}$×100%=75%,
故答案为:75%;
(4)①由表中数据可知,温度一定时,反应物投料比($\frac{n{H}_{2}O}{n(CO)}$ )越大,平衡时CO的体积分数越小,CO的转化率越高;反应物投料比($\frac{n{H}_{2}O}{n(CO)}$ )一定时,温度越低,平衡时CO的体积分数越小,CO的转化率越高,所以降低温度,增大反应物投料比($\frac{n{H}_{2}O}{n(CO)}$ )或原料气中水蒸气的比例,可以增大CO的转化率,
故答案为:降低温度;增大反应物投料比($\frac{n{H}_{2}O}{n(CO)}$ )或原料气中水蒸气的比例;
②尽管提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面,选择最佳温度为300℃,
故答案为:提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面;
③反应CO(g)+H2O(g)?CO2(g)+H2(g)中,反应前后气体的体积不变,则反应过程中气体的总体积不变,设反应原料气总体积为V,则CO的体积为30%VL=0.3VL,二氧化碳的体积为:10V%=0.1V,由于$\frac{n{H}_{2}O}{n(CO)}$=1,则加入的水蒸气的体积为0.3V,则反应达到平衡时气体总体积为:V+0.3V=1.3V,温度为300℃达到平衡时CO的体积分数为6%,则反应消耗的CO=生成的二氧化碳的体积=0.3V-1.3V×6%=0.222V,达到平衡时二氧化碳的体积分数为:$\frac{0.1V+0.222V}{1.3V}$×100%=24.8%,
故答案为:24.8%.
点评 本题考查化学平衡计算、化学平衡常数计算、化学反应速率与化学平衡影响因素等,题目难度中等,较好的考查了学生的分析、理解能力及灵活应用所学知识的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 碘和干冰的升华 | B. | 硅和冰的熔化 | ||
| C. | 氯化氢和氯化钾的溶解 | D. | 氯化钠和冰融化 |
| A. | 2mol甲醇参加反应,放出的热量为25kJ | |
| B. | 浓硫酸在反应中只作催化剂 | |
| C. | 2υ(CH3OH)=υ(CH3OCH3) | |
| D. | 升高温度或增大压强均可加快反应速率 |
| A. | S(s)+O2(g)=SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)=SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 |
| A. | 碳、氮、氧、氟的原子半径依次增大 | |
| B. | 硅、磷、硫、氯元素的最高正化合价依次升高 | |
| C. | 钠、镁、铝原子的最外层电子数依次增多 | |
| D. | 锂、钠、钾、铷的金属性依次增强 |
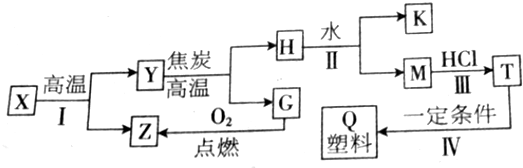


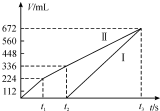 常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)