题目内容
7.下列说法中肯定错误的是( )| A. | 某原子K层上只有一个电子 | |
| B. | 某原子M层上电子数为L层电子数的4倍 | |
| C. | 某离子M层上的电子数为K层的4倍 | |
| D. | 阴离子的最外层电子数可能为2,也可能为8 |
分析 A.K电子层上最多容纳的电子数为2;
B.M层上最多只能排18个电子;
C.K层上最多只能排2个电子,2×4=8,M层上最多能排18个电子;
D.离子最外层可形成2电子或8电子稳定结构.
解答 解:A.K层上可排1个电子,也可最多排2个电子,如H原子的K层上只有一个电子,故A正确;
B.当M层上排有电子时,L层上一定排满了8个电子,而M层上最多只能排18个电子,18<8×4,没有这样的原子存在,故B错误;
C.K层上最多只能排2个电子,2×4=8,则M层为8个电子的离子为 ,可能是K+或Ca2+,故C正确;
,可能是K+或Ca2+,故C正确;
D.H-只有一层电子,最外层电子数为2电子稳定结构,阴离子的最外层电子数也可能为8,如O2-、F-等,故D正确;
故选B.
点评 本题考查考查微粒核外电子排布的有关知识,掌握核外电子排布的规律是解答关键,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
15.已知:S(l)+O2(g)=SO2(g)△H=-293.23kJ•mol-1,分析下列说法中正确的是( )
| A. | S(s)+O2(g)=SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)=SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 |
2.设NA为阿佛加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,8 g O2含有电子数目为4NA | |
| B. | 1 L 0.1mol/L的氯化铵溶液中NH4+的数目为0.1NA | |
| C. | 常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA | |
| D. | 含1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA |
12.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 酒精溶于水 | D. | HCl气体溶于水 |
16.下列递变情况中不正确的是( )
| A. | 碳、氮、氧、氟的原子半径依次增大 | |
| B. | 硅、磷、硫、氯元素的最高正化合价依次升高 | |
| C. | 钠、镁、铝原子的最外层电子数依次增多 | |
| D. | 锂、钠、钾、铷的金属性依次增强 |
17.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | SO2和SiO2 | B. | SiH4和H2S | C. | NaCl和HCl | D. | CCl4和KCl |
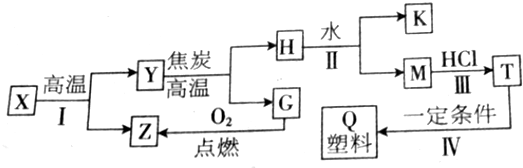

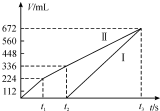 常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化) 或
或 .
. 、
、 、
、 .
.